| 时间:2024-09-27 |
2024年发表于《Journal of Clinical Investigation》(IF=13.3)
一、研究背景
m6A是高等真核生物中最常见的mRNA修饰,通过甲基转移酶复合物METTL3、METTL14和WTAP催化甲基化,FTO和ALKBH5去除甲基化。肾癌是最常见的泌尿生殖系统癌症,m6A在肾癌中有重要作用。在ccRCC中,VHL缺失如何影响m6A,m6A对PI3K/AKT通路的调控机制尚不清楚。
二、研究结果
1、VHL与m6A酶复合物蛋白结合
VHL是ccRCC中最重要的肿瘤抑制因子,VHL的Co-IP实验发现VHL与METTL3、METTL14和WTAP相互作用(图1F)。METTL3或METTL14的Co-IP实验也证实了其与VHL相互作用(图1、G和H),VHL与m6A调控之间有潜在联系。体外表达的GST-pull-down实验也揭示了VHL与METTL3或METTL14之间的相互作用(图1I)。VHL E3连接酶结构域可能对调节METTL3/14复合物的形成很重要。
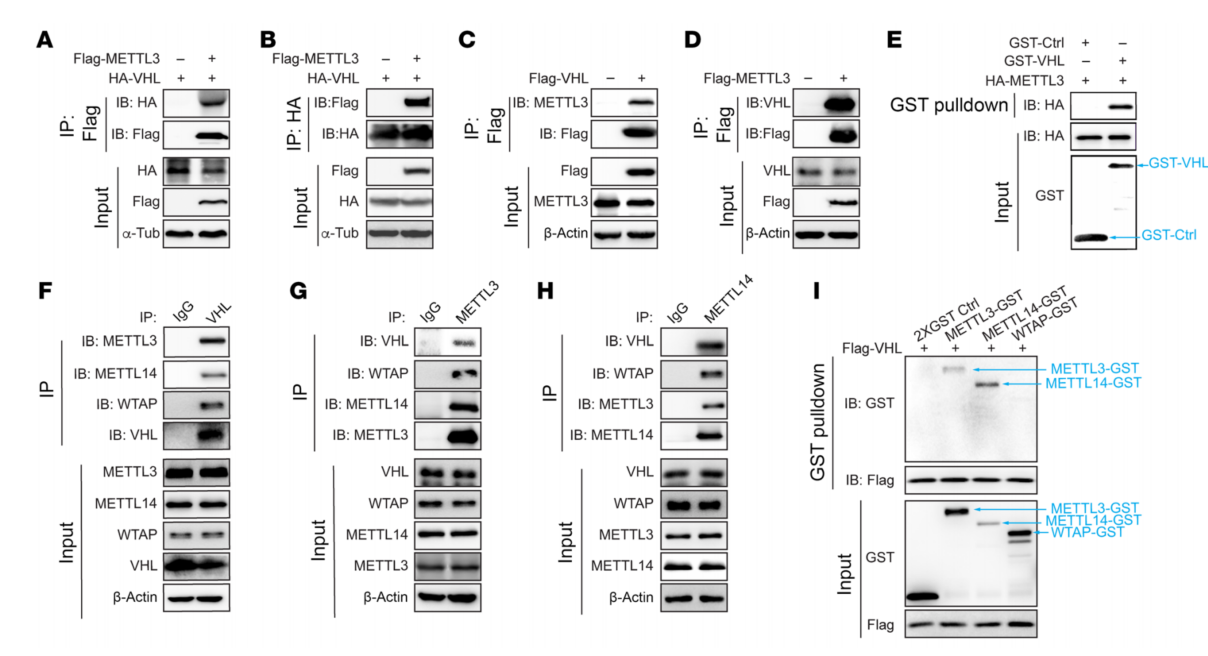
图1 VHL与m6A writer蛋白相互作用
2、VHL调节ccRCC细胞中m6A水平
为研究VHL是否可以调节肾细胞中的m6A水平。在HKC和293T细胞中用2种不同的sgRNA敲低VHL,并进行点印迹检测总m6A水平。VHL敲低导致两种细胞系中m6A水平下降(图2A)。VHL恢复可以挽救m6A敲低效应(图2B)。而缺乏E3连接酶的VHL突变体没有恢复,认为VHL对m6A的影响取决于其E3连接酶的活性(图2C)。用含有一致m6A GGACU基序的环状RNA GFP报告基因(图2E),GFP的强度可以作为细胞中m6A甲基化水平的直接读数。在HKC和293T细胞中通过sgRNA敲低VHL,发现这些细胞中VHL的敲低导致GFP降低(图2F),表明m6A降低。VHL过表达导致GFP升高(图2G)。综上可知,VHL正调控肾细胞中的m6A。
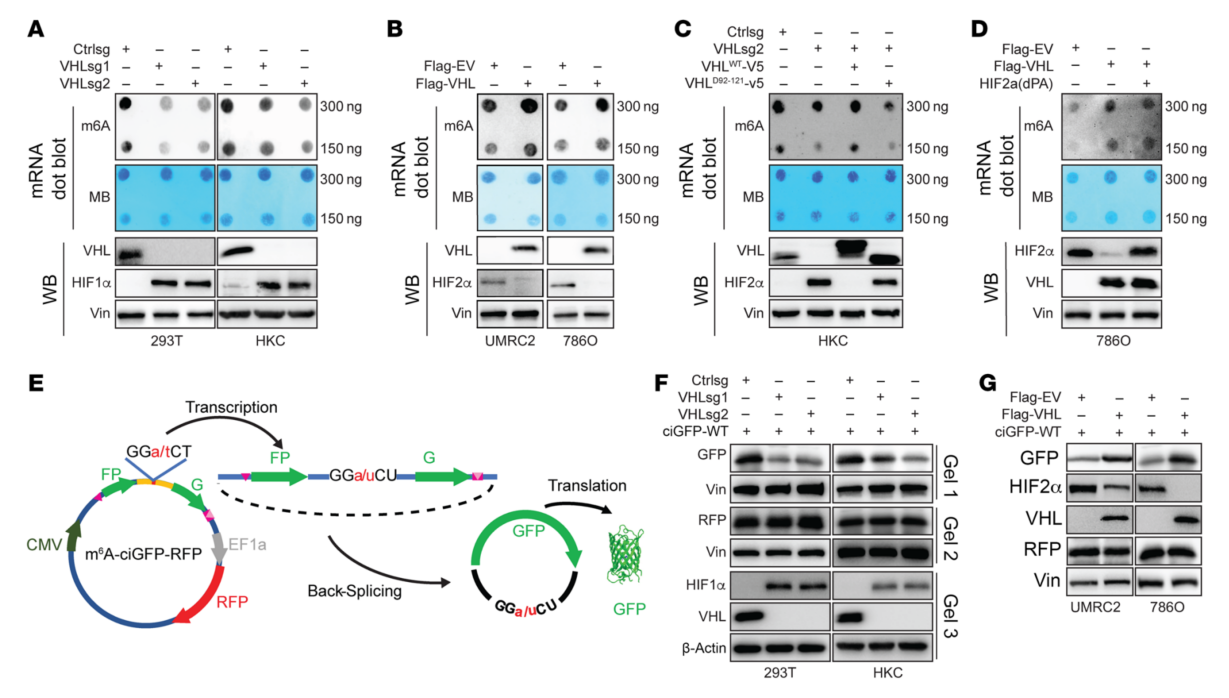
图2 VHL调控ccRCC中m6A的修饰
3、VHL调节METTL3和METTL14之间的相互作用
为研究VHL调控m6A的分子机制,先研究了VHL是否调节m6A writer复合物蛋白的蛋白水平。VHL敲低(通过sgRNAs)和VHL过表达都不会影响这些蛋白的水平。VHL的敲低导致METTL3和METTL14之间的结合减少(图3A)。VHL过表达导致METTL3/METTL14结合增加(图3B)。VHL以剂量依赖的方式促进METTL3/METTL14(图3D)。然而,体外甲基化活性测定并未显示随着VHL量的增加而增加METTL3/METTL14复合物活性,这表明VHL对METTL3/14复合物活性的影响可能不是直接的,而是依赖于细胞环境。
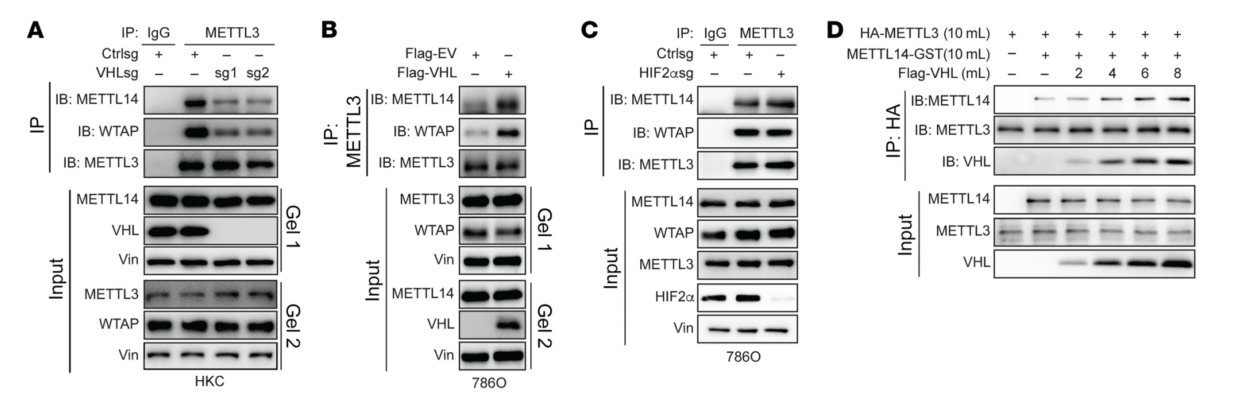
图3 VHL调控METTL3和METTL14之间的相互作用
4、通过MeRIP-Seq鉴定VHL调控的m6A位点
为研究VHL调控的潜在下游靶基因与m6A修饰关系。进行MeRIP-seq,分析了m6A抗体下拉富集的基序,发现从所有细胞系(Ctrlsg、VHLsg1或VHLsg2)中检索到典型的m6A基序序列GGAC(图4A);大多数m6A峰富集在靠近3 ' UTR的区域(图4B)。发现VHL敲低导致m6A位点数量减少,这与VHL缺失导致METTL3-METTL14结合减少的观察结果一致。
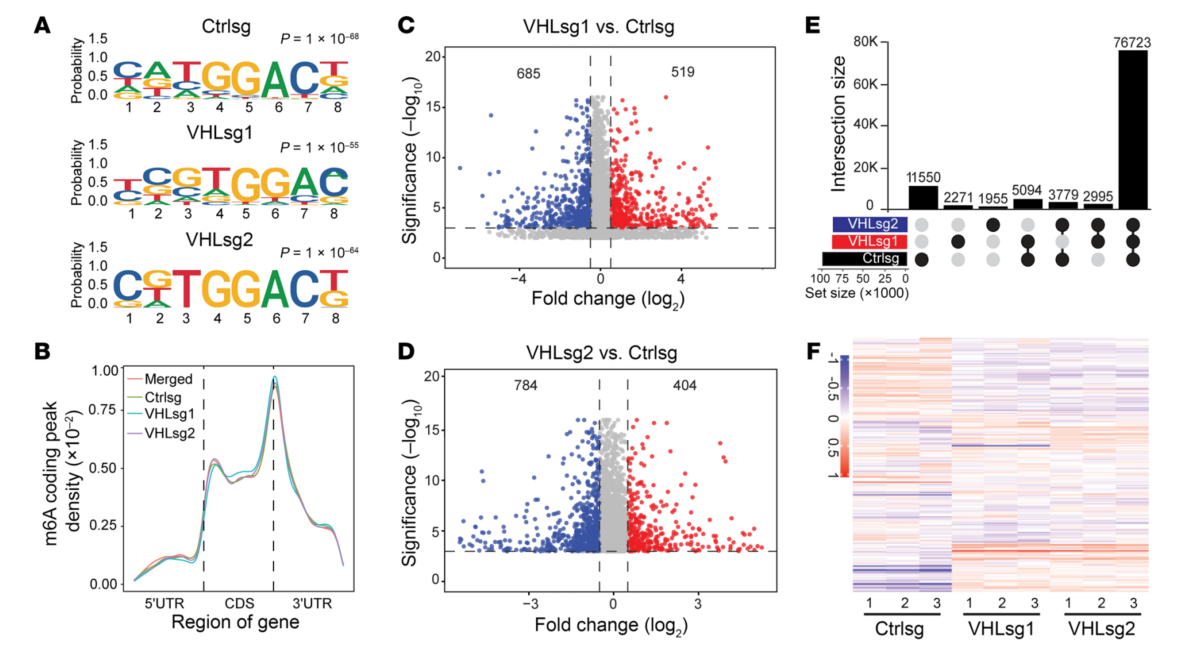
图4 VHL缺失后不同m6A的全转录组鉴定
5、通过对m6A RIP-Seq和RNA-Seq的综合分析来鉴定VHL调控的mRNA
为了检测m6A修饰调控的基因表达,进行了RNA-seq,关注VHL敲低后差异调控的基因(图4F)。通过对两种策略筛选到的2个靶基因列表取交集,得到了13个基因的短列表,用以验证它们的差异基因表达和m6A的差异富集(图5、D和E)。VHL敲低导致PIK3R3、PTK2B和PFKFB3 3 ' UTR区域的m6A占用减少(图5G),RNA水平降低(图5H)。MeRIP-PCR也证明VHL敲低导致m6A在PIK3R3、PTK2B和PFKFB3 3 ' UTR区域的占用减少(图5I)。此外,VHL敲除导致这些基因上的METTL3占用减少(图5J)。
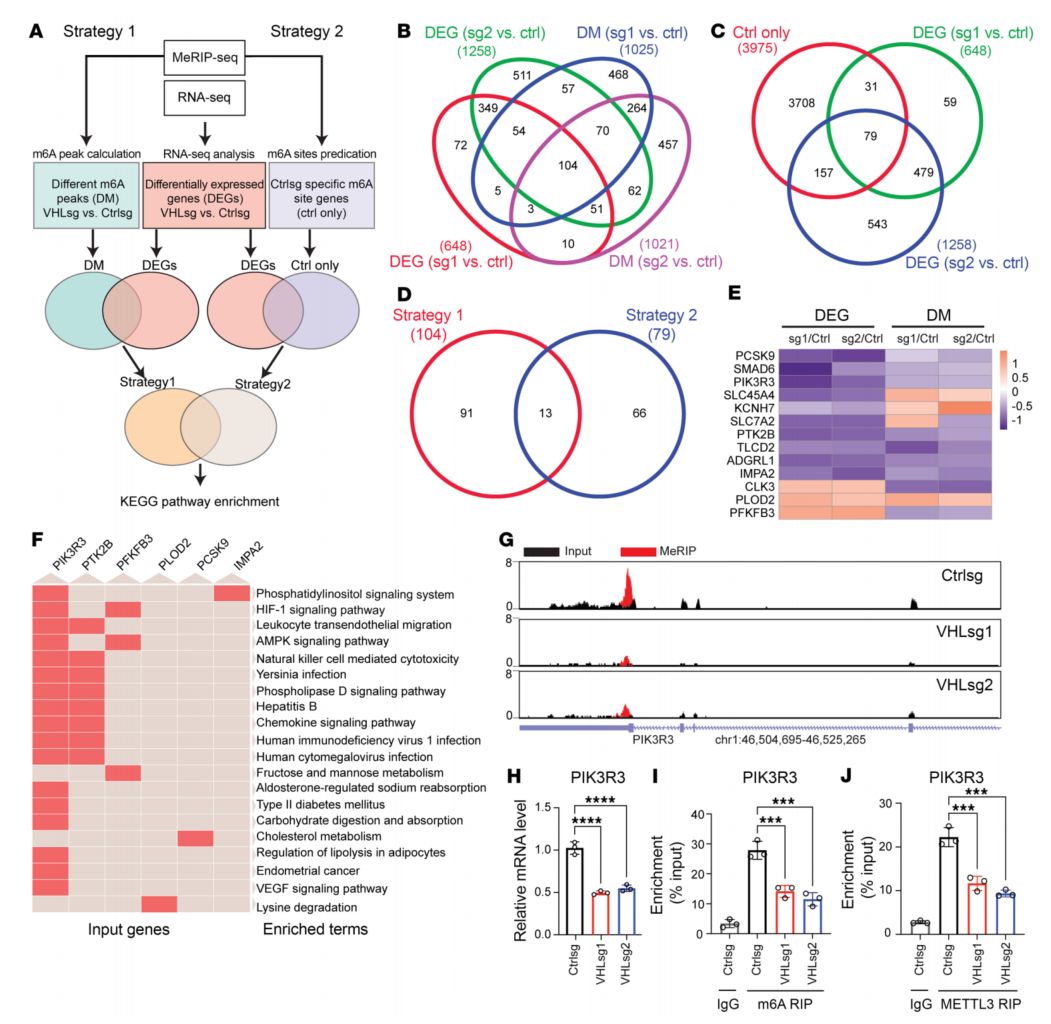
图5 RNA-Seq和m6A-Seq检测确定了m6A修饰的VHL潜在靶点
6、VHL以m6A和IGF2BP依赖的方式调控PIK3R3 mRNA的稳定性
为确定VHL是否可以调节m6A靶基因mRNA的稳定性,VHL敲低时表现出更快的RNA衰变(图6A和B),VHL过表达导致PIK3R3 mRNA稳定性增加(图6、C和D)。发现当METTL3敲低后,WT报告基因活性降低,而Mut报告基因活性不受影响(图6F、G、H、I),这表明该报告基因可以概括细胞中的m6A活性。VHL过表达导致m6A WT报告基因活性增加,而Mut报告基因活性不增加(图6J-M)。VHL以依赖m6a的方式调节PIK3R3 mRNA的稳定性。进一步实验证明VHL对PIK3R3 mRNA的调节不是通过影响IGF2BP水平,而是通过控制m6A修饰来介导的。数据表明IGF2BP1和2可能是VHL调节的m6A信号的主要m6A Reader。
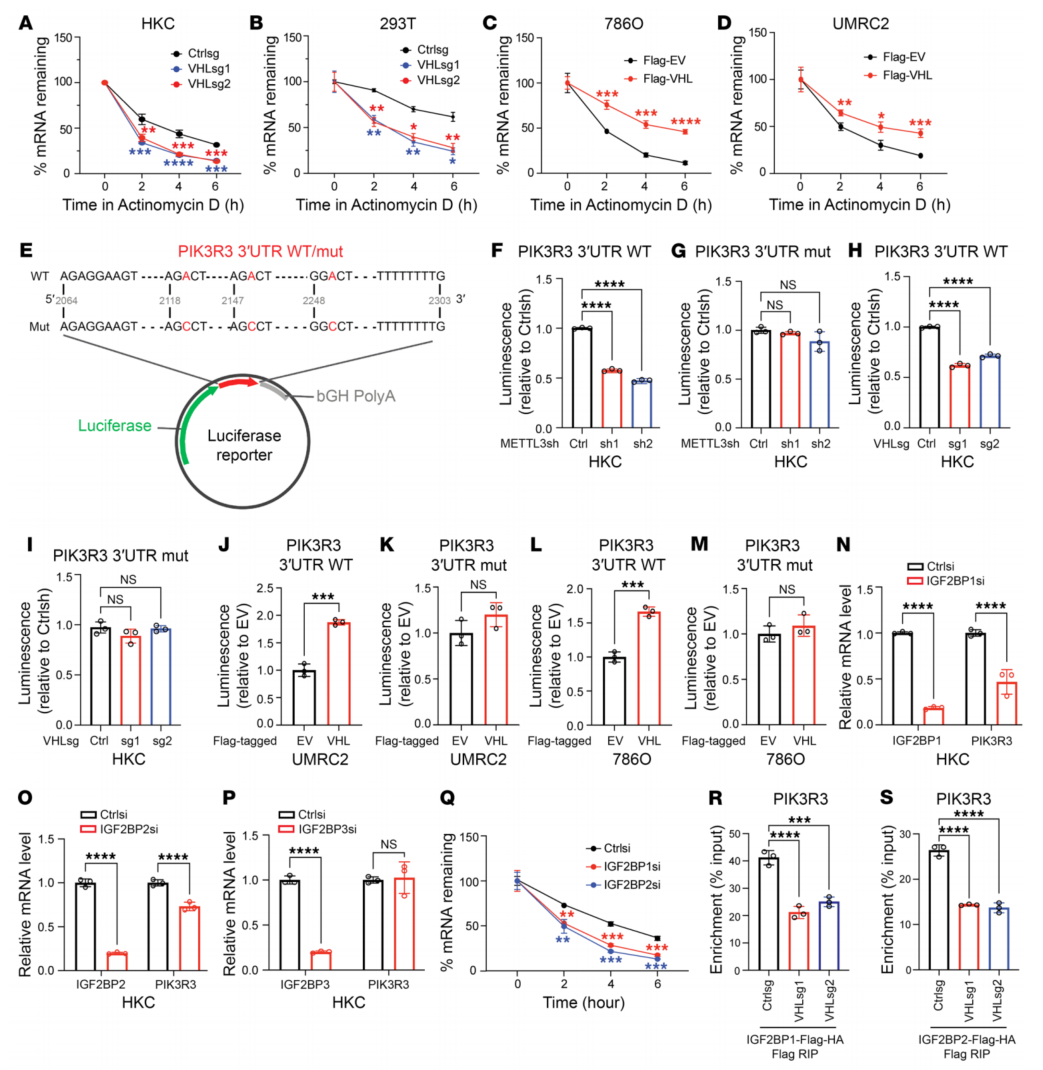
图6 VHL以m6A依赖的方式调节PIK3R3 mRNA的稳定性
7、VHL在ccRCC中调节PIK3R3蛋白水平
为进一步证实PIK3R3 mRNA水平受VHL调控,sgRNAs敲低VHL,PIK3R3 mRNA减少,PIK3R3蛋白水平下降相对应(图7A、B)。过表达VHL,PIK3R3 mRNA和蛋白水平升高(图7、C和D)。挽救实验发现VHL过表达完全挽救了对PIK3R3 mRNA和蛋白表达的影响。VHL对PIK3R3 mRNA和蛋白水平的影响依赖于其E3连接酶活性(图7F)。VHL对PIK3R3的调控与HIF无关(图7G)。VHL对PIK3R3的正向调节依赖于E3连接酶且不受HIF的影响。
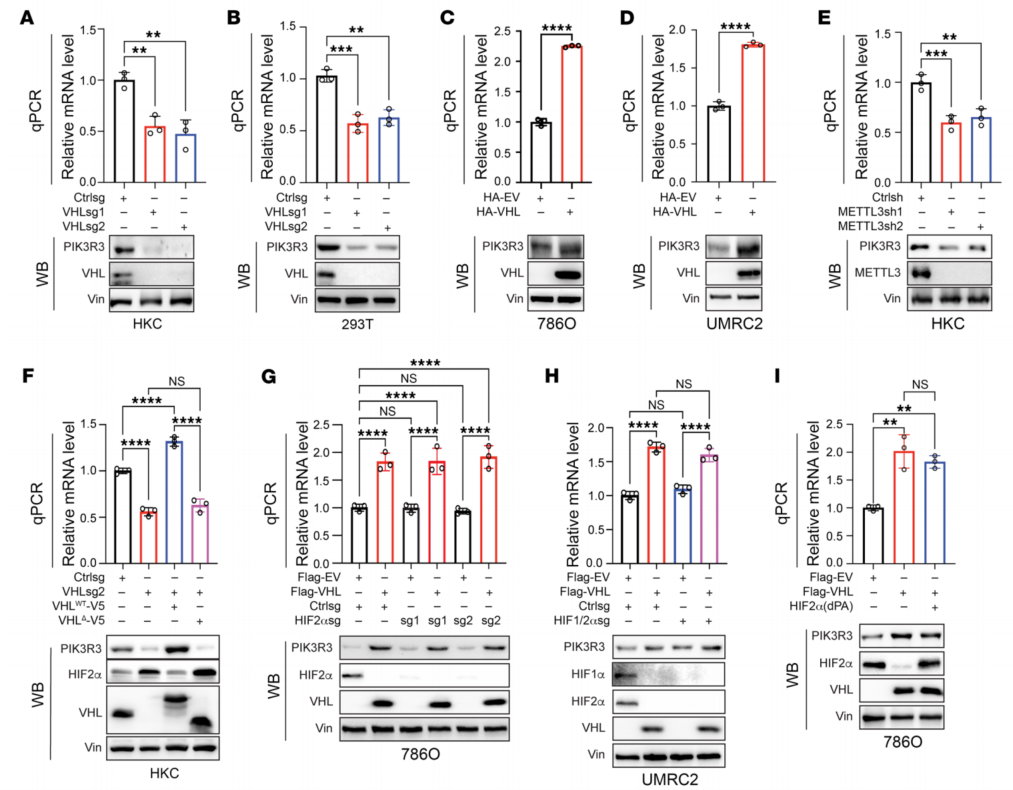
图7 VHL正向调控ccRCC细胞中PIK3R3 mRNA和蛋白水平
PIK3R3与VHL蛋白水平之间存在很强的相关性。与正常样本相比,ccRCC肿瘤中PIK3R3的mRNA水平降低(图8A),表明PIK3R3在ccRCC的发展过程中丢失(图8B、C)。FFPE样本免疫组化,发现ccRCC肿瘤中PIK3R3蛋白水平降低(图8D、E)。使用IMmotion151临床亚型和TCGA数据集进行的生存分析表明,PIK3R3 mRNA水平的降低与ccRCC患者更高的生存率相对应。综上所述,VHL在ccRCC中正调控PIK3R3。
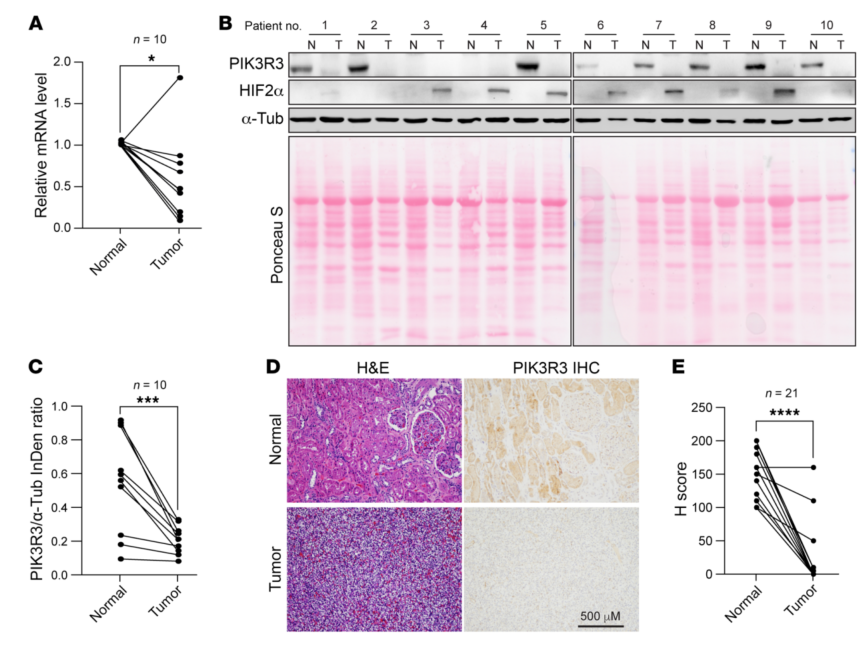
图8 PIK3R3在人ccRCC中表达下调
8、PIK3R3在体内和体外均能抑制肿瘤的生长
为了研究PIK3R3在ccRCC中的作用,在HKC细胞中去除PIK3R3,PIK3R3缺失导致2-D和3-D集落形成增加(图9A-C),过表达PIK3R3,并观察到两种细胞系的2-D和3-D细胞生长下降(图9D-I)。
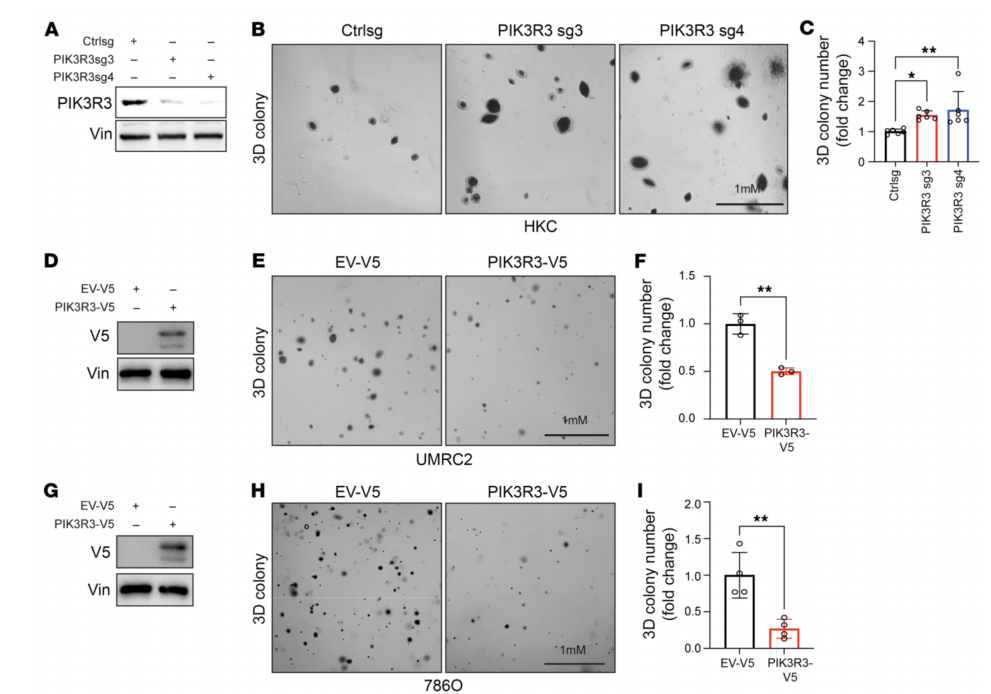
图9 PIK3R3在体外抑制肿瘤生长
PIK3R3被敲低会随着时间的推移导致肿瘤进展加快(图10A-D),在UMRC2细胞中过表达PIK3R3,观察到肿瘤进展和肺转移减缓和大小减少(图10E-H)。总体而言,PIK3R3缺失导致肿瘤发生增加,而其过表达导致ccRCC肿瘤进展减少。因此,PIK3R3可能在ccRCC中起到肿瘤抑制因子的作用。
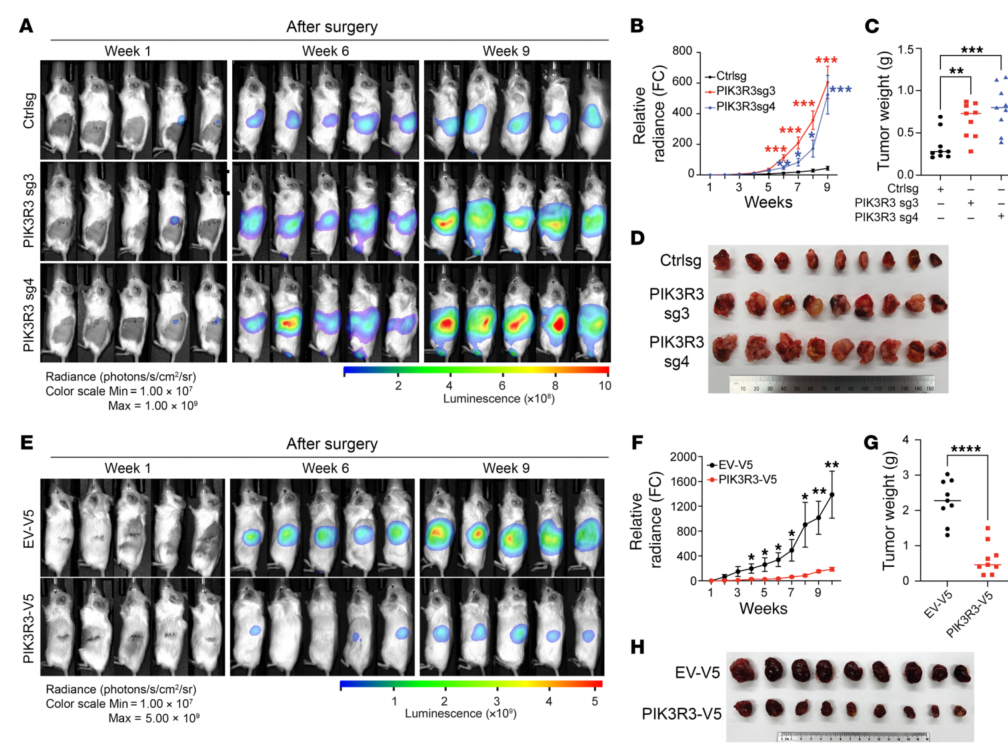
图10 PIK3R3在体内抑制肿瘤生长
9、PIK3R3通过拮抗PI3K的激活来抑制ccRCC
为研究PIK3R3调控肾肿瘤发生的分子机制,再HKC细胞中敲低PIK3R3,发现PIK3R3缺失导致丝氨酸473和苏氨酸308残基上的pAKT增加(图11A),这是激活PI3K信号的重要指标。PIK3R3过表达导致pAKT信号传导减少(图11B-D)。综上所述,PIK3R3是PI3激酶激活的负调节因子。研究了PIK3R3对PI3K信号传导中的关键信号分子(包括p85、p110-α和p110-β)的影响。PIK3R3缺失导致肾细胞中p85水平升高,而其过表达导致p85亚基降低(图11F-I)。
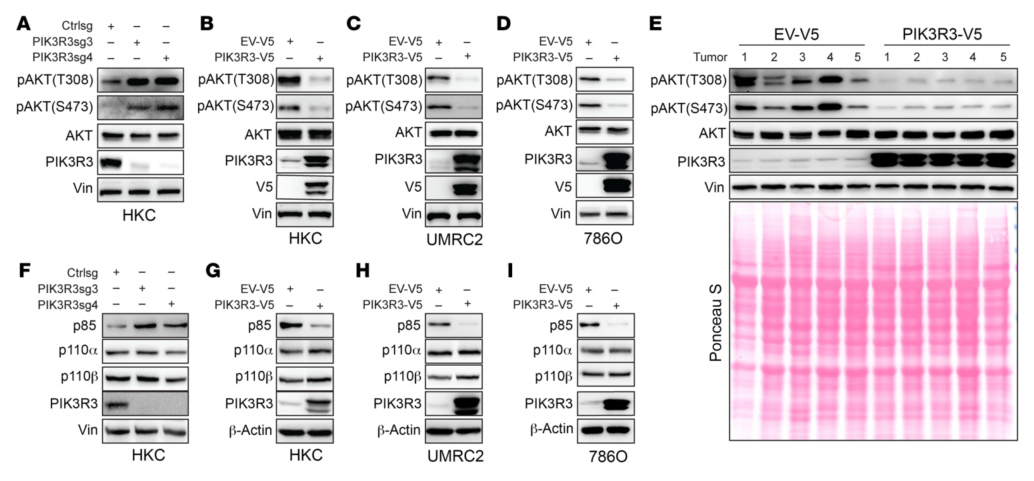
图11 PIK3R3抑制AKT信号
p85含有2个亚基,包括p85-α和p85-β。同时靶向敲低p85-α和p85-β,两种异构体的缺失都会导致pAKT的减少(图12A、B)。VHL缺失导致PIK3R3蛋白水平降低,这与p85蛋白水平升高和pAKT水平升高相对应(图12C)。在FFPE样本中,与正常样本相比,ccRCC肿瘤中pAKT(308)水平降低(图12、G和H)。PIK3R3调节p85蛋白的稳定性。综上所述,认为VHL积极调节通过以m6a依赖的方式稳定其mRNA,从而导致PIK3R3的增加。PIK3R3稳定导致p85泛素化增加和p85蛋白水平降低,从而导致ccRCC中AKT磷酸化降低。
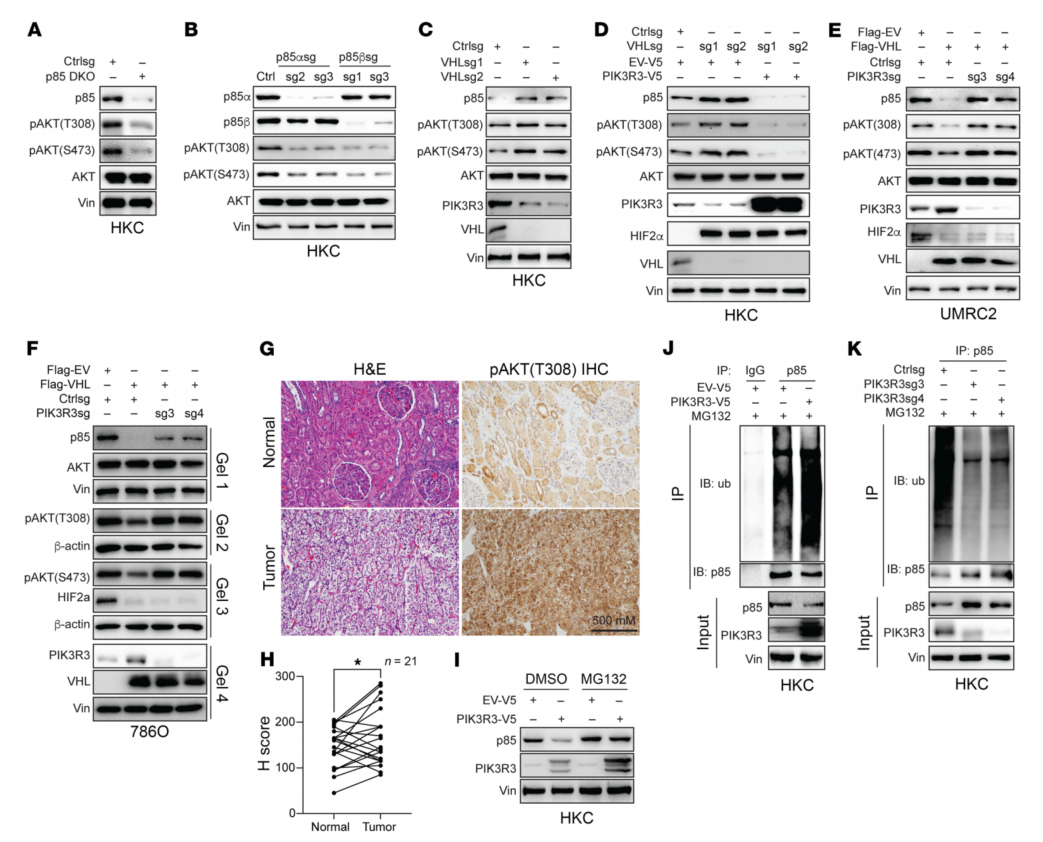
图12 VHL通过上调PIK3R3来抑制AKT信号通路
三、研究结论
VHL通过调节METTL3/METTL14复合物形成来调节m6A,从而促进PIK3R3 mRNA的稳定性和蛋白水平,PIK3R3通过抑制PI3K/AKT活性来抑制肿瘤生长。
参考文献:
Von Hippel Lindau tumor suppressor controls m6A-dependent gene expression in renal tumorigenesis.[J]Journal of Clinical Investigation, 2023.