| 时间:2024-07-19 |
2023年发表于《Cell Reports》(IF=7.5)
一、研究背景
胰腺β细胞对维持葡萄糖稳态至关重要,其可通过增加胰岛素的产生、分泌、β细胞数量来适应代谢需求;β细胞数量会随着年龄增长和2型糖尿病(T2D)患病而下降。在严重的代谢应激下,β细胞表现出功能受损、胰岛素含量丧失、去分化,最终导致β细胞死亡或增殖。影响β细胞复制的细胞内过程包括胰岛素产生、β细胞成熟、未折叠蛋白反应(UPR)和内质网应激。β细胞具有显著的胰岛素生成能力,主要在翻译水平受到调节,并通过对内质网应激的高耐受性来维持。然而,对代谢应激时β细胞的调控机制尚不清楚。FoxM1是一个关键的转录因子,它调节出生后β细胞的更替和增殖,以在高代谢需求或损伤期间维持β细胞数量。FoxM1控制介导PLK1依赖性细胞周期进程调控的转录。
在本研究中,采用成年小鼠急性胰岛素抵抗β细胞代偿模型来研究染色质重塑和基因表达、调节UPR、蛋白质合成、线粒体功能和胰腺β细胞增殖的时间序列。观察到染色质重组的早期可塑性,以及控制细胞分裂和蛋白质合成的增殖性β细胞(PβCs)的独特转录和功能特征。同时发现FoxM1调节蛋白翻译、内质网应激反应、线粒体生物发生和β细胞活性。
二、研究结果
1、急性代谢应激引起β细胞可塑性、内质网应激、蛋白质合成和增殖的变化
为了研究β细胞功能在早期代谢应激中的精确时间模式,用胰岛素受体拮抗剂S961处理在小鼠,诱导高血糖和胰岛素抵抗(图1A)。为了揭示β细胞功能的时间异质性,使用流式细胞术分析了PBS或S961处理24或72小时的Ins1-GFP小鼠的β细胞粒度。PBS处理小鼠的β细胞粒度大多较高(SSC-high,称为P72H)(图1A和1B)。S961处理24小时后,观察到2个β细胞亚群:高粒度群体(称为S24H),低粒度群体(称为S24L)。S961给药72小时后,与PBS相比,S72L细胞中的胰岛素含量明显降低(P72H vsS72L)(图1C)。脱颗粒的S24L细胞分泌的胰岛素明显少于S24H β细胞(图1D)。这种急性表现的异质性粒度和胰岛素释放的显著变化揭示了不同的分子和功能β细胞亚群。
为了更好了解β细胞在早期代谢应激中的异质性,结合RNA-seq和ATAC-seq数据对P72H、S24L、S24H和S72L细胞进行了时间过程实验(图1D)。RNA-seq分析发现24小时后已经出现主要差异。表明在代谢应激反应中存在早期表达异质性,并且首先脱颗粒的细胞会产生更强烈的转录反应。对S961和PBS处理的亚群的差异表达基因进行富集分析。与P72H相比,上调基因中“蛋白质代谢”、“ER中的蛋白质加工”和“翻译”是所有S961处理的细胞(S24H、S24L和S72L)中最富集的途径(图1E)。与此分析一致,测量了S961细胞中细胞质、线粒体40S/60S核糖体蛋白(RPs)和真核翻译起始因子(eIF)转录物组分的水平升高(图1F-1I)。结果表明在代谢应激期间,胰岛素分泌早期下降的β细胞会首先启动一个表明细胞进入细胞周期和增殖的转录特征。下调基因在富集途径分析中仅显示弱关联。在S961处理的72小时内,Dit3/Chop(内质网失代偿应激的标志),在处理过程中逐渐降低(图1J)。总的来说,S961给药72小时后,促凋亡、内质网应激和蛋白酶体转录显著减少,表明β细胞补偿是通过激活β细胞存活和增殖途径介导的。
胰岛素合成的增加对于代谢应激的初始代偿阶段是重要的。发现lns1转录物水平在高粒度β细胞中迅速上调(S24H)(图1L)。然而,与PBS对照相比,S24L细胞中胰岛素mRNA水平没有差异,这表明这些细胞对胰岛素分泌的代偿反应贡献较小,但首先启动向增殖的过渡。此外,insulin、Pcsk1、Pcsk2和CPE转录本在72h时增加(图1L)。相比之下,分化标记物的转录水平保持不变,表明β细胞没有去分化。这些发现表明S24H表型主要是由胰岛素增加而不是β细胞身份基因表达驱动的。
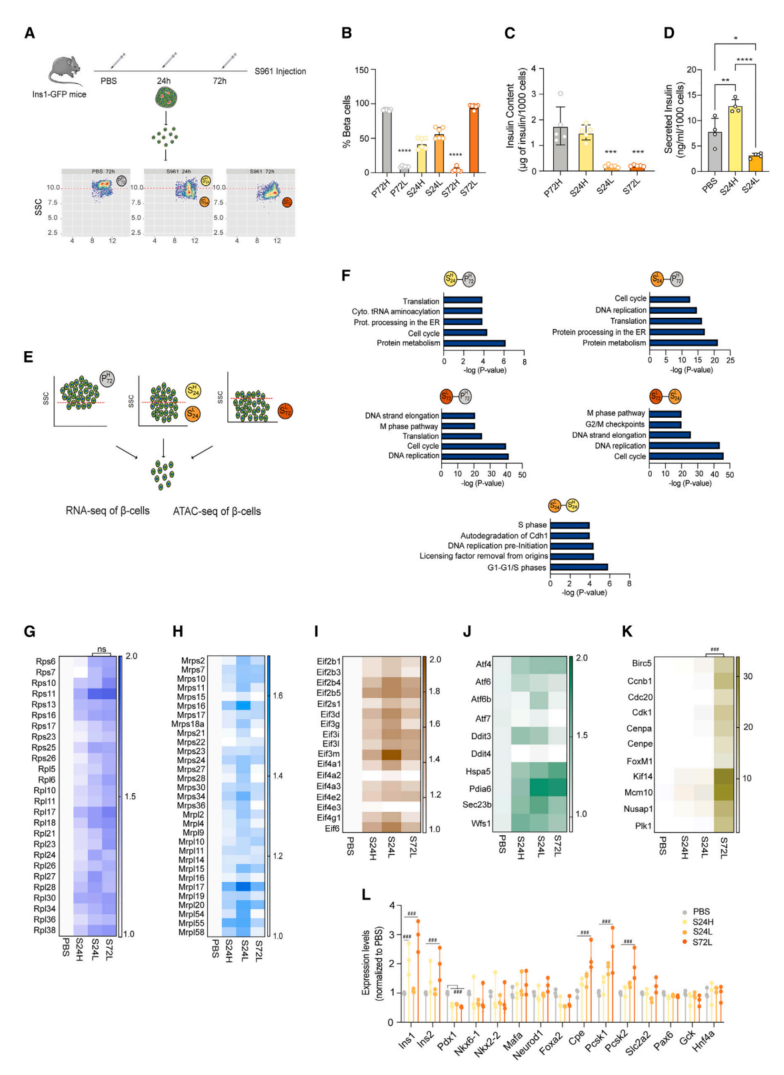
图1 早期代谢应激诱导β细胞可塑性、内质网应激、翻译和增殖的变化
2、染色质可及性的改变是代谢应激的早期反应
为进一步研究转录调控机制,分析了来自转基因Ins1-GFP小鼠的P72H、S24L、S24H和S72L β细胞亚群的ATAC-seq。对不同细胞群的差异可及性(DA)位点总数进行分析,发现S24L、S72L、P72H和S24H和S72L的DA位点比P72H和S24H多33,895个(图2A)。表明代谢应激诱导染色质可及性的早期改变,大多数改变发生在低粒度的细胞中。大多数可及性位点位于靠近TSS的启动子区域(图2B),基因间区或内含子可及性较低(图2C)。
为了分析染色质可及性与基因表达之间的关系,对RNA-seq和ATAC-seq联合分析。分析了自S961处理第1天起染色质可及性增加的基因(图2D),发现“内质网蛋白加工”和“展开蛋白反应”基因集富集(图2D)。确定了一种内质网(ER)伴侣蛋白Hspa5,是蛋白折叠和质量控制所需的基因。给药24小时后,Hspa5启动子染色质可及性和RNA转录水平上调。此外,UPR相关基因也有所增加(图2E和2F)。在S961处理72h时,分析ATAC-seq发现与“细胞周期”、“DNA复制”和“M期途径”相关的富集基因集(图2G)。这些基因(Cdk1、Nusap1、Mki67、Cdc20和Prc1)的启动子染色质开放,在脱颗粒的S72L β细胞中表达上调(图2H和2I)。在代谢应激期间,一些基因的可及性增强,使得很多调控因子可以介导转录过程。
在蛋白质水平上对RNA-seq和ATAC-seq的整合分析结果进行了验证,对注射S961或PBS的小鼠免疫印迹。发现与PBS相比,S961处理后24小时内翻译量已经增加(图2J)。但72h后蛋白质合成率下降,说明翻译在24h后被部分阻断(图2J)。有趣的是,对FACS分选、嘌呤霉素标记的S24H和S24L细胞的分析显示,增加的蛋白质合成主要发生在S24H细胞(图2K和2L)。总的来说,这些结果表明应激信号、染色质可及性和转录之间有很强的协调性,它们都控制着急性代谢应激时异质β细胞群中的蛋白质合成。
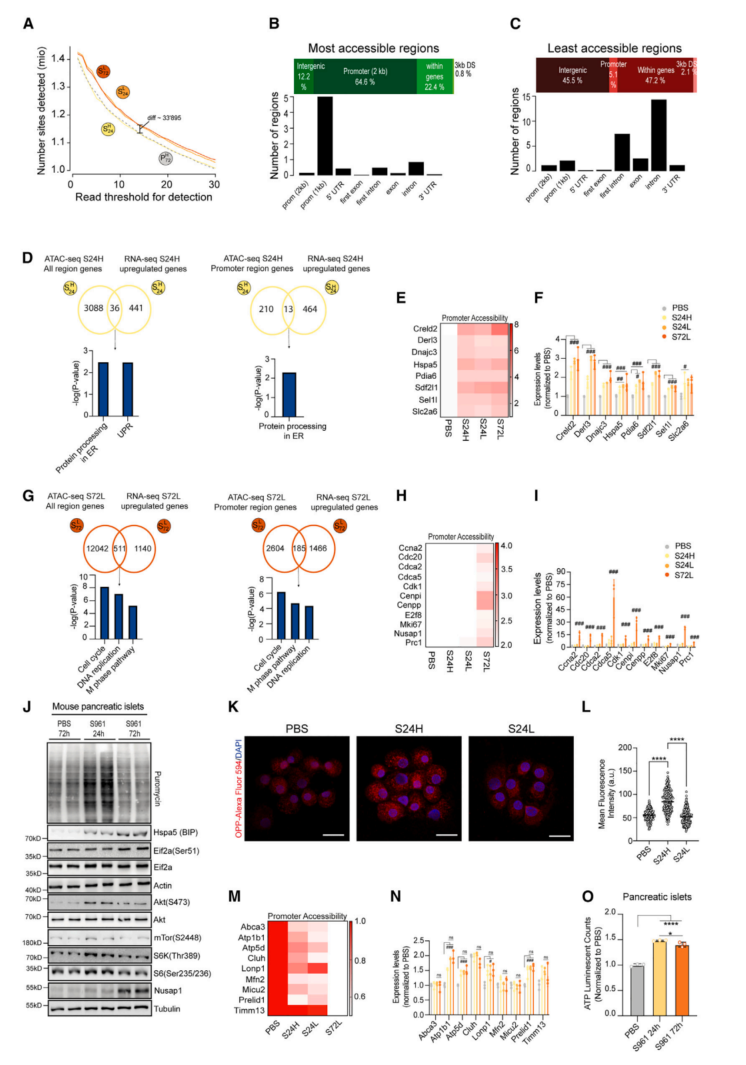
图2 染色质可及性的改变是代谢应激的早期反应
3、不同的转录和功能特征控制着增殖性β细胞(PβCs)中的蛋白质合成
从S961处理72h的RIP-Cre3 tdTomato小鼠分选β细胞,通过scRNA-seq分析了PβCs和静止β细胞的转录调控,以研究β细胞增殖对蛋白质合成调控的影响(图3A)。通过Ins1/2的表达证实了β细胞的纯度,基于β细胞标记物Ins1/2和增殖标记物Mki67/CcnB1的表达,通过使用t-SNE分析显示,Mki67阳性细胞均匀分布,不局限于特定的簇(图3B),表明所有分化的β细胞在S961处理72小时后具有相同的增殖和分裂潜力。殖和静止细胞的差异表达分析(表S1)显示,与非增殖β细胞(QβCs)相比,PβCs中有218个转录本上调,77个轻度下调转录本。上调的富集基因集揭示了“细胞周期”、“DNA复制”和“M期”途径(图3C),与增殖标志物Birc5、Nuspa1、FoxM1和Cenpa的表达增加一致(图3D)。引人注目的是,PβCs中下调的基因在“翻译”和“内质网蛋白加工”途径中富集(图3C),这与核糖体和内质网应激相关基因的表达减少(图3E和3F)一致。此外,参与β细胞功能的基因(Ins2,Chga,Chgb)在增殖细胞中也减少(图3G)。
为了进一步表征PβCs的生物学特征,从注射S961或PBS 72小时的CcnB1-GFP+转基因小鼠的分散胰岛中筛选CcnB1-GFP+细胞。比较了经过S961处理72小时后,RIP-Cre×tdTomato小鼠(βCs)和CcnB1-GFP+动物CcnB1+细胞的β细胞的表达情况(图3H)。通过测量增加的CcnB1、Mki67以及有丝分裂和细胞分裂相关转录物(图3I、3J),证实了分选的细胞确实具有增殖性。S961处理小鼠胰腺组织切片的β细胞中,有丝分裂标志物P-组蛋白3(H3-Ser10)的免疫荧光染色也增加(图3K),从而验证了模型的有效性。当比较增生性Ins+/CcnB1+(CycB1)与所有β细胞(βCs)之间的基因表达谱时,发现与scRNA-seq PβCs与QβCs中上调基因一样富集于“DNA复制”、“细胞周期”和“M途径”(图3C)。增殖CycB1细胞中被抑制的基因富集于“翻译”和“ER中的蛋白质加工”相关的基因集(图3L-3O)。β细胞功能标记物在增殖细胞中被抑制(图3P)。
这些结果揭示了在增殖细胞中β细胞必需基因的全局性转录下调,因此假设在有丝分裂和细胞分裂过程中,蛋白质合成和能量供应可能减少。为了验证这一点,药物化合物特异性地干扰细胞周期进程的不同阶段:Ro3306(一种CDK1抑制剂)在G2/M过渡时阻止细胞周期,Pifithrin-α(一种肿瘤抑制P53抑制剂)促进G2/M过渡和细胞分裂事件,测量了ATP产生和蛋白质合成。在Ro3306处理的细胞中,ATP水平和蛋白质合成增加,而Pifithrin-α处理的β细胞则引起相反的反应(图3Q-3S)。分析显示单细胞ATP水平在G1期间逐渐增加,在G2时达到最高水平,在细胞分裂后急剧下降(图3T和3U)。总之,这些结果说明细胞质和线粒体RP转录物的显著下降,以及有丝分裂中PβCs的ATP水平和蛋白质合成的降低。
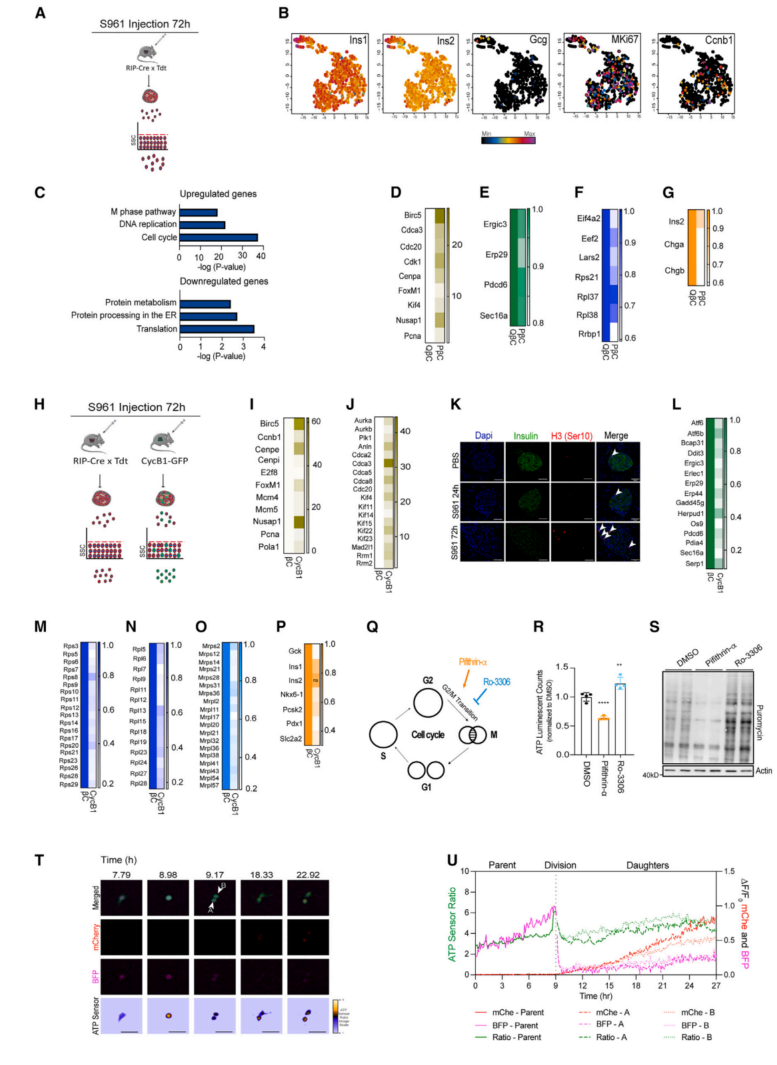
图3 不同的转录和功能特征控制着增殖性β细胞(PβCs)的蛋白质合成
4、FoxM1调节蛋白合成和内质网应激反应
为了确定在β细胞增殖和代谢应激过程中可能作为内质网应激、蛋白质合成和增殖的主要调节因子的特定转录因子,结合bulk RNA-seq和scRNA-seq数据,对差异表达基因进行了转录因子富集分析(ChEA),预测相关上游转录因子。该分析确定FoxM1是最富集的转录因子(图4A)。值得注意的是,FoxM1转录物水平在S72L与P72H中上调5.9倍,在PβCs与QβCs中上调4.7倍,在CycB1与βCs中上调20倍(图1K、3D和3I),S961处理小鼠胰岛中的FoxM1蛋白水平也是如此(图4B和4C)。在β细胞代偿过程中FoxM1表达是如何上调的还不完全清楚。核心FoxM1启动子区域包含几种转录因子的结合位点,其中只有E2F1在S24H细胞中已经上调,并且在处理过程中升高。这表明E2F1可能激活β细胞中FoxM1的表达。并验证了E2F1通过直接结合FoxM1启动子的E2F元件激活FoxM1的表达。
嘌呤霉素标记的分散胰岛的western blot分析显示,与对照细胞相比,Ad:FoxM1胰岛的蛋白质合成减少(图4D)。此外,在FoxM1高表达的Min6细胞中,FoxM1的沉默导致蛋白合成增加(图4E)。这些结果表明FoxM1调节β细胞中的蛋白质合成。此外,在正常情况下,β细胞中FoxM1的沉默增加了细胞凋亡,这表明FoxM1在β细胞存活中起着有益的作用(图4E)。在研究FoxM1在内质网应激中的作用时,这些数据得到了证实。TG处理的FoxM1缺失的Min6细胞显示eIF2a-Ser51磷酸化增加,cleaved caspase-3水平升高,表明更高的凋亡率(图4F)。此外,FoxM1过表达引发了保护作用(图4G),表明β细胞中FoxM1的激活是减轻内质网应激所必需的。
为了进一步探索FoxM1、内质网应激和蛋白质合成之间的联系,在高糖环境中培养72小时后,分别对表达FoxM1或对照(GFP)腺病毒(Ad)、Ad:FoxM1或Ad:GFP感染的胰岛进行了RNA-seq。与FoxM1的作用一致,DNA复制基因在FoxM1过表达时增加(图4H)。Ins1/2水平不变,与β细胞功能相关的基因仅轻度减少(图4I),这一发现与增殖细胞一致,其中FoxM1上调(图3D和3I)。与内质网应激相关的几个基因被减少(图4J),这一发现与FoxM1在代谢应激中内质网应激诱导的细胞凋亡的保护作用一致。
对FoxM1过表达的胰岛的RNA-seq分析也显示线粒体转录物水平降低,包括27个RP(图4K)。此外,在FoxM1过表达的β细胞中,14个线粒体编码基因的表达显著降低(图4L)。此外,在Ad-FoxM1感染的细胞中,ATP合成酶的13个转录本(图4M)和NADH:泛醌氧化还原酶复合物的16个转录本(图4N)下调。这些发现揭示了FoxM1水平与线粒体基因表达之间负相关。免疫荧光分析显示GFP-FoxM1蛋白定位于线粒体、细胞质和细胞核(图4O)。此外,内源性FoxM1的生物化学亚细胞分级显示FoxM1在线粒体中显著存在(图4P)。

图4 FoxM1调节蛋白合成和内质网应激反应
5、FoxM1调节线粒体编码基因的转录并控制线粒体的生物发生和功能
为了探讨FoxM1在线粒体代谢中的作用,分析了细胞呼吸、ATP产生、线粒体含量和呼吸复合物的活性以及FoxM1过表达。在Ad:FoxM1感染的β细胞中,基础呼吸、ATP连接、最大呼吸和备用能力下降(图5A和5B)。此外,FoxM1在原代分散胰岛和Min6细胞中的过表达降低了细胞ATP水平(图5C和5D)。与24小时相比,S961处理小鼠的离体胰岛在72小时也观察到细胞ATP的减少(图20),这是β细胞中FoxM1高度上调的时间点(图1K)。相反,在FoxM1缺失的细胞中,ATP水平升高(图5E)。由于线粒体DNA(mtDNA)拷贝数反映了线粒体的丰度,因此采用qPCR方法测量mtDNA拷贝数。分散胰岛中FoxM1的过表达在72h后降低了Ad:FoxM1感染细胞的mtDNA拷贝数(图5F),而在Min6细胞中沉默FoxM1增加了mtDNA含量(图5G)。测量了过表达FoxM1的Min6细胞的蛋白质合成,以模拟代谢应激期间FoxM1活性的增加,发现线粒体和细胞质部分的翻译率都下降了(图5H-5J)。
为了更好地了解FoxM1调控翻译的机制,在感染了v5标记Ad:FoxM1的Min6细胞中做ChIP-seq,以鉴定FoxM1靶基因。ChIP-seq分析显示FoxM1在细胞周期和有丝分裂基因的启动子中富集结合(图S5C),FOXM1在整个线粒体基因组的正向和反向链上广泛但不均匀地结合(图5K)。此外,RNA-seq分析显示,5种线粒体tRNAs(mt-tRNAs)、2种线粒体核糖体RNA(mt-Rnr1,2)、细胞色素b(mt-Cytb)、mt-Co1和5种NADH脱氢酶1亚基的转录水平下降(图4L)。为了评估FOXM1对线粒体编码基因的下调是否也发生在原代人β细胞中,从Lawlor等人那里获得了scRNA-seq数据,并比较了表达FOXM1(βFOXM1+)的β细胞和无法检测到FOXM1转录物(βFOXM1-)的β细胞。在1471个显著的DEG中,只有59个在表达FOXM1的细胞中低水平表达,其中7个是线粒体编码基因(图5L);这一结果支持在小鼠β细胞中激活FoxM1的发现。相比之下,在βFOXM1+细胞中表达水平升高的1412个基因中,没有发现线粒体编码的基因。βFOXM1+细胞中下调转录本的基因本体(GO)分析揭示了线粒体功能相关途径(图5M)。总的来说,这些数据证明了FoxM1作为β细胞线粒体编码基因的负转录调节因子的保守和特异性功能。
当整合RNA-seq和ChIP-seq数据时,发现FoxM1直接调节mt-ND1和mt-CO1的表达水平(图4L)。ChIP-qPCR分析,证实mt-ND1和mt-CO1上游序列区域的FoxM1高度富集(图S5G)。此外,分析它们的上游序列,分别在125和376 nt内鉴定出典型叉头(FKH)DNA结合元件(图S5H)。综上所述,本研究证明FoxM1在代谢应激时上调,导致线粒体FoxM1活性增加,抑制线粒体基因表达、翻译、ATP产生和全局翻译,从而减轻内质网应激,促进细胞周期和细胞存活。
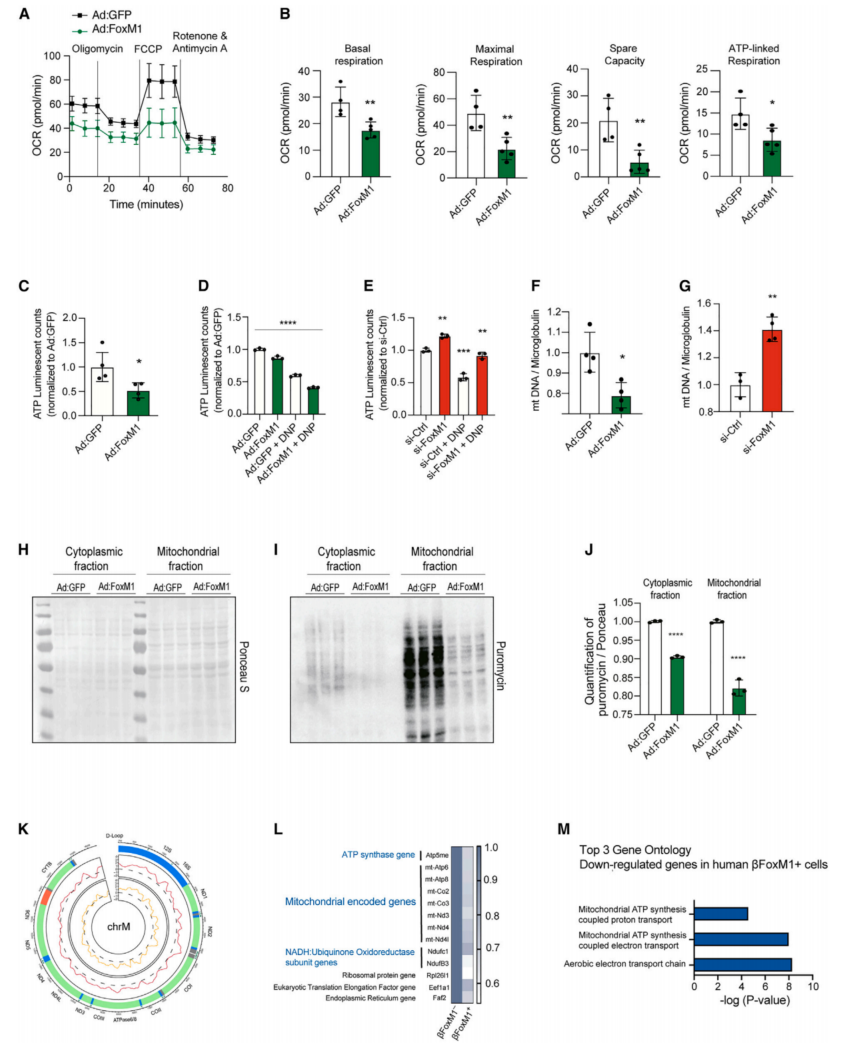
图5 FoxM1控制线粒体的生物发生和功能
三、研究结论
急性代谢应激会导致β细胞可塑性、内质网应激、蛋白质合成和增殖的变化,并且在早期会引起染色质可及性的变化。FoxM1是代谢应激的关键转录因子,通过直接抑制线粒体编码基因,调节蛋白质合成、内质网应激和线粒体活性,从而影响β细胞。
参考文献:
FoxM1 coordinates cell division, protein synthesis, and mitochondrial activity in a subset of b cells during acute metabolic stress.[J]Cell Reports, 2023.