| 时间:2024-07-12 |
2023年发表于《Journal of Experimental &Clinical Cancer Research》(IF=11.3)
一、研究背景
前列腺癌(PCa)是全球第二大诊断癌症和第五大男性癌症死亡原因,迫切需要寻找新的准确的前列腺癌预测标志物和治疗靶点。通过对两个PCa队列的全基因组和转录组测序数据集的分析,在所有其他拷贝数扩增的潜在因果基因中GATA2排在首位,这使其成为PCa潜在靶点。
GATA2是GATA结合转录因子家族的成员,可促进前列腺肿瘤的生长和转移。转化生长因子-β(TGF-β)在癌症早期,TGF-β作为肿瘤抑制因子,通过诱导细胞周期阻滞和凋亡来阻止不受控制的增殖。在癌症晚期,TGF-β促进细胞迁移、侵袭和血管生成,导致肿瘤转移。SMAD4或DPC4作为TGF-β信号转导下游效应蛋白,可导致TGF-β在癌症进展中的多效性作用。本研究的结果支持GATA2和SMAD4之间的体内相互作用,从而试图揭示TGFβ1/SMAD4在GATA2依赖的背景下对PCa肿瘤进展的机制作用,并了解GATA2和SMAD4如何介导遗传性PCa风险。
前列腺癌是一种最具遗传性的疾病,环境和遗传因素都有助于前列腺癌的易感性和进展,尤其是家族遗传。全基因组关联研究(GWASs)发现了270多个与PCa易感性相关的单核苷酸多态性(SNP)位点。风险SNP通常通过调节关键转录因子如HOXB13、FOXA1和AR的染色质结合来影响基因调控。考虑到GATA2与这些蛋白之间的相互关系,以及本研究新发现的控制GATA2的TGFβ1/SMAD4信号传导,推断GATA2及其相互作用因子可能解释了更多支持PCa易感性的基因调控机制。
在本研究中,发现GATA2拷贝数扩增和过表达与转移相关,并通过正反馈调节回路调控自身的表达,与PCa的不良临床预后相关,并促进PCa细胞的侵袭和转移。GATA2与SMAD4相互作用,促进TGFβ和AR信号通路,通过直接与TGFβ1的远端增强子结合,转录激活TGFβ1的表达。GATA2和SMAD4在全基因组范围内介导了遗传性PCa风险。该研究为进一步开发遗传标记提供了新的见解,对理解体细胞基因组改变和遗传基因变异之间的相互作用调控PCa进展也至关重要。
二、研究结果
1、GATA2的扩增和上调与前列腺癌转移相关
通过两个PCa基因组数据集频繁扩增区域内的基因列表和相关RNA-seq分析数据,发现58个基因在PCa患者的肿瘤中显示出拷贝获得与表达水平升高之间的正相关。并进行了Kaplan-Meier估计分析,发现该基因集表达水平较高的PCa患者分别与生化复发和转移的风险升高相关。整合了一组全基因组CRISPR/cas9介导的PCa细胞系LNCaP的功能丧失筛查数据,并观察到GATA2,编码已知转录因子在所有其他拷贝数扩增的潜在因果基因中排名第一,对PCa细胞存活表现出最强的必要性(图1a)。通过合并[17]独立的PCa基因组数据集,检测了不同种族人群中GATA2的扩增状态,发现GATA2扩增在这些研究中非常普遍(图1b)。
为了评估GATA2基因组改变是否对前列腺癌有临床影响,评估了GATA2拷贝数增益与其在人类前列腺肿瘤中的表达水平之间的潜在相关性。结果显示,GATA2拷贝数增加的患者组中,GATA2的表达水平更高(图1c、d),这与之前的观点一致;在匹配的邻近正常前列腺组织中未观察到这种相关性。此外,前列腺癌中GATA2的高表达水平与肿瘤进展到转移(图1e)、较高的Gleason评分(图1f)、肿瘤分期晚期和PSA水平升高具有高度相关性。还发现GATA2表达水平较高的PCa患者与生化复发和转移的风险升高相关(图1g,h),这与先前认为GATA2上调或转录活性增加与PCa患者预后不良呈正相关的观点一致。为了进一步探讨GATA2表达水平是否对PCa低风险病例具有预测价值,根据Gleason评分对两大PCa患者队列进行分层,并检查GATA2表达与疾病严重程度之间的潜在相关性。该分析表明,GATA2 mRNA水平对Gleason评分为7分的PCa患者的生化复发和转移具有明确的预测价值(中危,图1i,j),但对Gleason评分≤6分的低危病例或Gleason评分≥8分的高危病例(图无明确的预测价值。这些结果表明,GATA2是区分可能复发的PCa患者的潜在独立预后标志物。
接下来研究了GATA2扩增是否与前列腺癌转移相关,从而在多个独立的数据集中检测了原发性和转移性前列腺癌患者中GATA2拷贝数增加的比例。结果显示,与PCa原发肿瘤相比,转移患者中GATA2的扩增频率要高得多(图1k)。GATA2的扩增和上调与前列腺癌转移密切相关,表明其在前列腺癌发生和肿瘤进展中的作用。基因集富集分析(GSEA)结果显示,与GATA2二倍体肿瘤相比,具有GATA2增益/扩增的PCa肿瘤中缺失的所有基因集中,“CHANDRAN Metastasis DN”基因特征(在转移性与非转移性前列腺癌中下调的基因)是最富集的基因集(图11)。与此相一致的是,在表达高水平GATA2 mRNA的PCa肿瘤中,发现相同的基因标记明显缺失(图1m),进一步表明GATA2在调节PCa转移中的功能。
接下来,为了评估GATA2拷贝数改变对人类PCa进展的临床影响。结果显示,GATA2拷贝数增加的患者组与较高的Gleason评分(图1n)、晚期肿瘤分期、PSA水平升高和淋巴结密切相关。Kaplan-Meier生存评估,以研究GATA2拷贝增益与患者预后的关系。结果一致表明,在两个不同的PCa队列中,GATA2拷贝增加的PCa患者生化复发、转移的频率显著增加,生存期较短(图1o-q)。综上所述,GATA2高频率的基因组扩增与其表达增加相关,而GATA2扩增和过表达与前列腺癌向转移的进展密切相关,并在前列腺癌风险预测中具有潜在的预后价值。
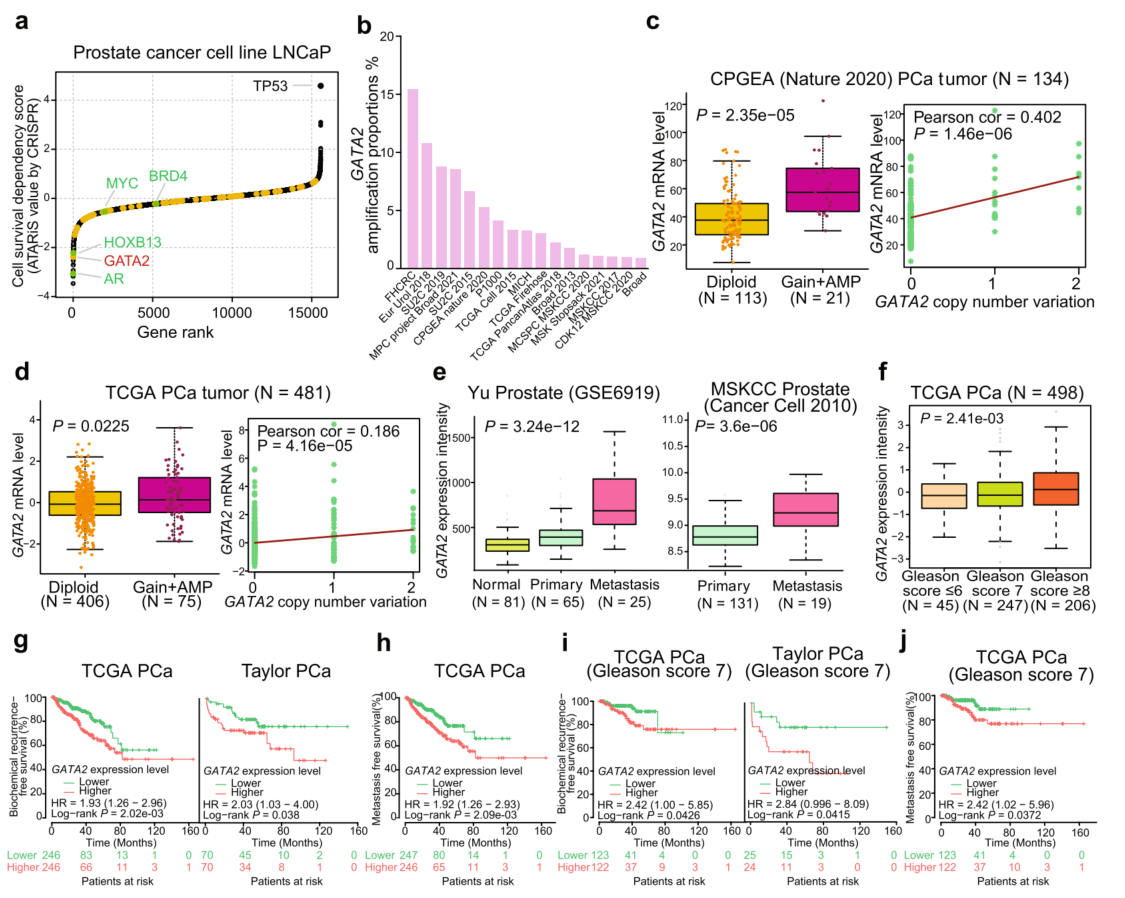
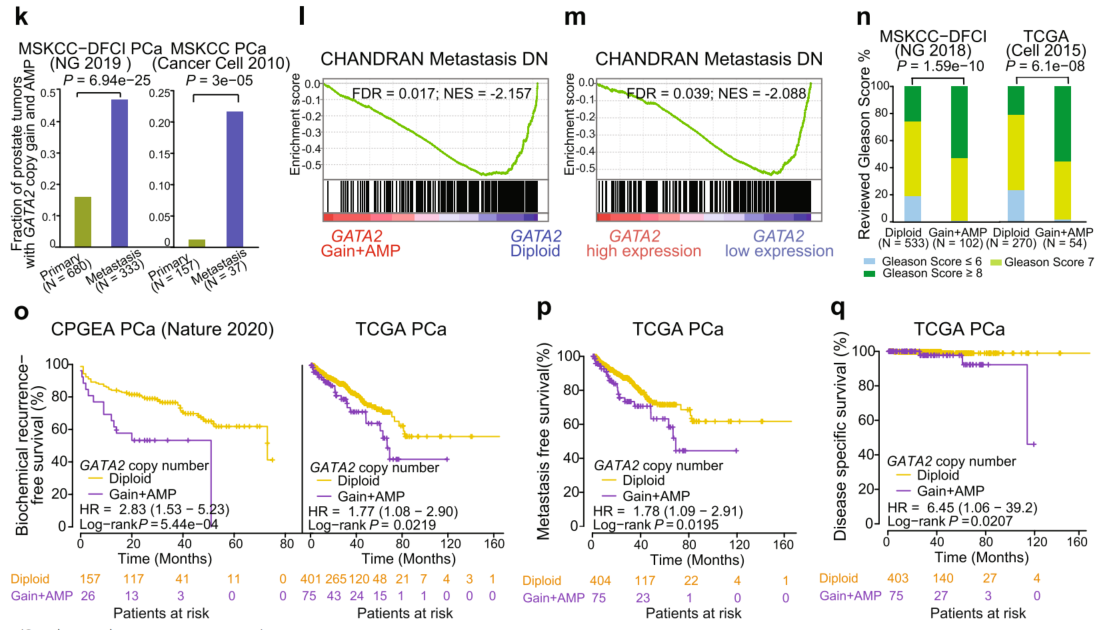
图1 GATA2基因组的扩增和上调与PCa患者的肿瘤进展和不良预后相关
2、GATA2通过一个正反馈调节回路来调控自己的表达
为阐明GATA2过表达异常转录控制的机制。在公开的人类全基因组ChIP-seq数据集中检索了Citstrome DB,发现转录因子GATA2本身在PCa细胞中对其基因组区域具有最大的调节潜力。事实上,在其转录起始区观察到GATA2的强结合位点(图2a)。对GATA2进行了ChIP-qPCR,发现该区域的GATA2高度富集(图2b),为自动调节提供了证据。
GATA2结合信号在基因组区域与H3K27ac和H3K4me1共同富集,H3K27ac和H3K4me1是活性增强子或超级增强子的表观遗传标志,以及RNA聚合酶II(图2c),表明GATA2高度参与了全基因转录过程。为了确定GATA2是否与强增强子结合以增强自身表达,根据结合信号对每个基因中GATA2结合的活性增强子进行排序,发现GATA2位点上的超级增强子是PCa细胞中排名最高的GATA2靶点。为了检验GATA2增强子是否直接调控GATA2的表达,进行了CRISPR/Cas9介导的GATA2结合增强子区域的功能性缺失。通过qRT-PCR和Western blot检测,发现增强子区域的缺失降低了PCa细胞22Rv1中GATA2 mRNA和蛋白的表达(图2d)。与GATA2表达下降一致,使用诱导细胞检测系统,观察到与亲本细胞相比,缺失增强子的克隆的细胞增殖下降(图2e)。为了进一步研究GATA2结合的增强子是否负责GATA2的表达,分别在增强子敲除克隆和对照细胞中进行了GATA2的异位表达。发现外位强迫表达GATA2时,内源性GATA2 mRNA水平在克隆1和克隆2细胞中分别增加了1.52倍和1.72倍,明显低于对照细胞的4.71倍(图2f),进一步支持GATA2结合增强子介导其自身表达。
接下来探索了其他转录因子在该区域调节GATA2表达的可能性,并通过Cistrome ToolKit进行了分析。结果表明,转录因子包括GATA2、CREB1、E2F1和MYC可能结合到LNCaP细胞的增强子区。但敲低CREB1或E2F1对GATA2表达无影响,而过表达MYC可轻微下调GATA2表达。总的来说,除了GATA2,这些预测转录因子不太可能通过上述研究的GATA2增强子调节GATA2的表达。综上所述,以H3K4me1和H3K27ac为界的GATA2超级增强子促进了GATA2的表达,并且GATA2与该区域结合,从而形成了一个正反馈调控回路来增加其自身在PCa中的表达。
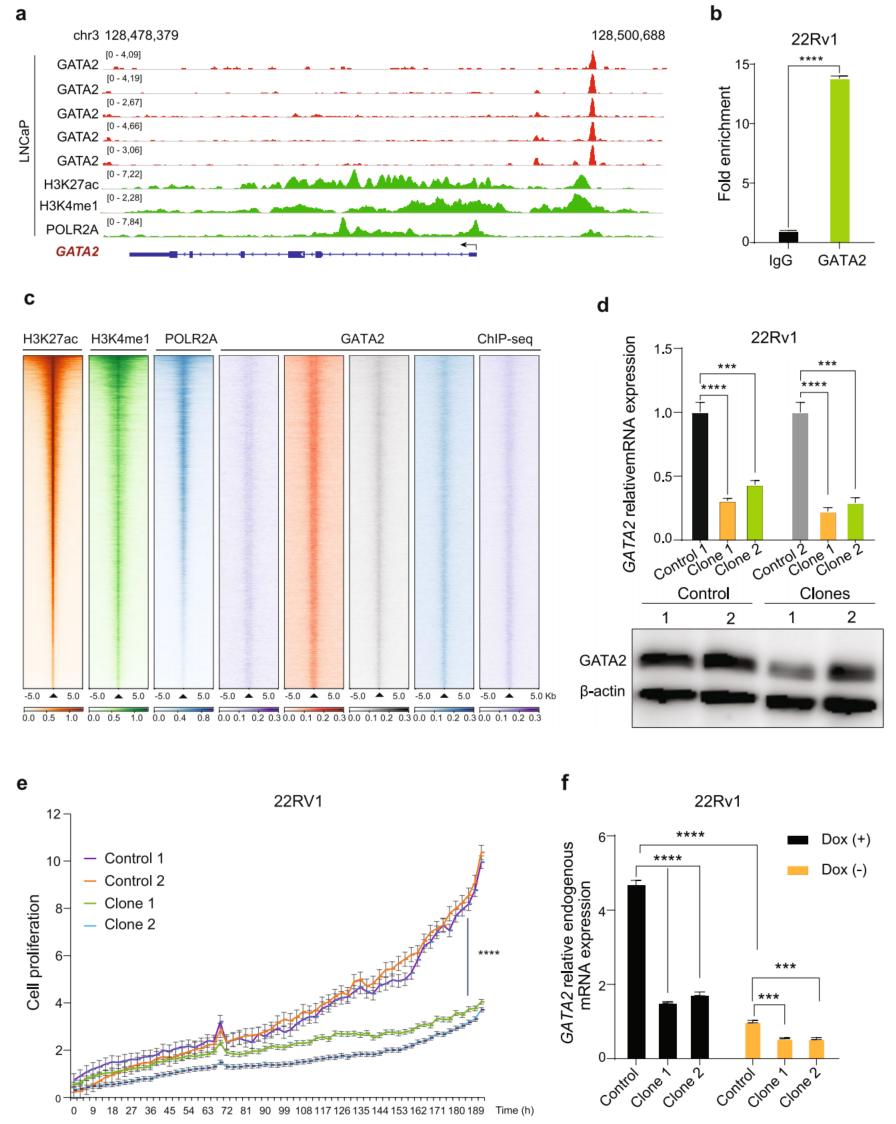
图2 GATA2通过一个正反馈调节回路来调控自己的表达
3、GATA2可增强PCa细胞的增殖和转移
为了进一步研究GATA2上调在PCa中的作用,在不同的PCa细胞系中,包括LNCaP、LNCaP-1F5(1F5)、V16A和22Rv1中进行了siRNA或shRNA介导的GATA2下调(图3a、b)。如图3a-c所示,转染了针对GATA2的siRNA或shRNA的细胞其增殖显著降低。与全基因组CRISPR/cas9筛选数据一致,表明GATA2是PCa细胞存活最重要的基因(图1a)。GATA2导入到dox诱导的基因表达载体中,建立了多GATA2过表达稳定细胞系RWPE2-GATA2、1F5-GATA2、V16A-GATA2、22Rv1-GATA2和PC3-GATA2。结果显示,与对照组相比,dox诱导组伤口愈合明显(图3d、e)。同样,上调GATA2也增加了RWPE2、PC3、1F5、22Rv1和V16A细胞的侵袭能力(图3f、g)。
鉴于上述GATA2上调与前列腺癌转移之间的临床相关性(图1e、h、j-m、p),接下来通过实验证实了GATA2在转移中的作用,并通过尾静脉注射或左心室注射将RWPE2-GATA2细胞或PC3-GATA2细胞接种到SCID雄性小鼠体内。与对照组相比,dox诱导组小鼠出现了更多的肺或骨转移(图3h,i),表明过表达GATA2促进了体内细胞转移。为了进一步验证GATA2在体内肿瘤细胞增殖中的作用,将shRNA介导的GATA2敲低22Rv1细胞或shRNA scramble细胞皮下注射到SCID雄性小鼠中。如图3j-1所示,GATA2敲低组肿瘤体积和重量均低于对照组,表明GATA2在体内促进前列腺癌细胞增殖。qRT-PCR分析结果显示,GATA2的缺失下调了细胞增殖驱动基因MYC的mRNA水平,上调了细胞生长抑制基因P21和PTEN的mRNA水平(图3m-o)。此外,GATA2的下调会减弱细胞转移相关基因VEGF和TWIST1的表达(图3p、q)。以上结果说明了GATA2对PCa细胞增殖和转移的作用。
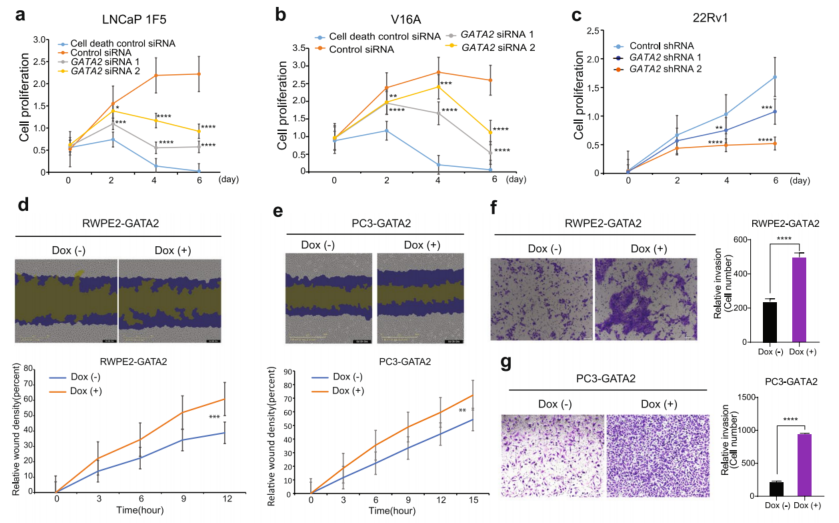
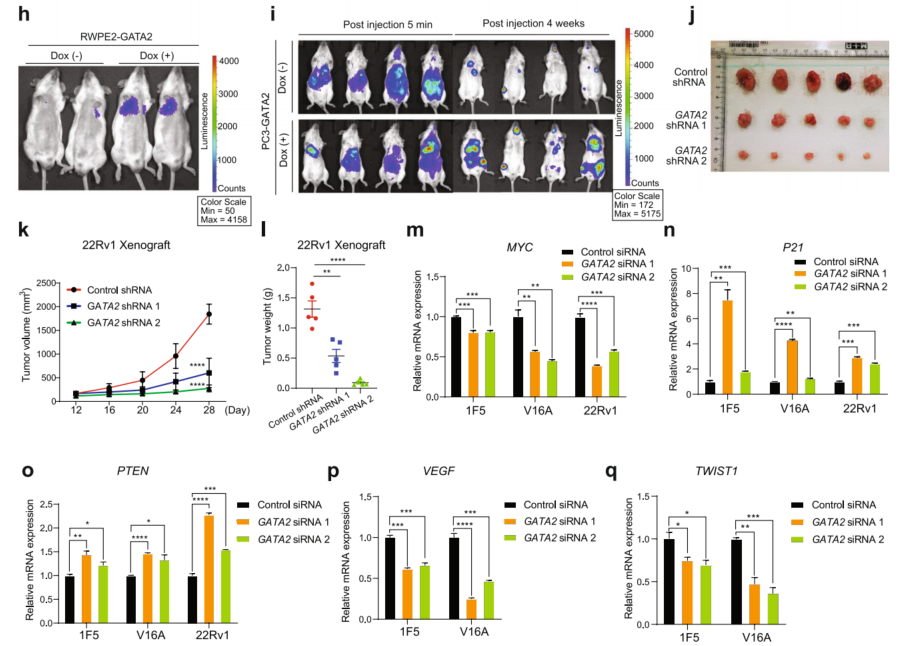
图3 GATA2可增强前列腺癌的增殖和转移
4、GATA2与SMAD4相互作用,全基因组范围内共同调控PCa基因和癌症转移途径
GATA2作为先锋转录因子,能够与封闭染色质的DNA区域结合,启动其他调节蛋白的分层招募和占用,并形成复杂的转录蛋白复合物。为了更好地了解GATA2过表达和扩增的致癌功能,查询四个独立的PPI数据库与GATA2相互作用的蛋白,并且交集;找到包括SMAD4在内的10种可能直接与GATA2相互作用的的蛋白(图4a)。为了研究这些GATA2相互作用物对细胞存活的重要性,将这10个基因映射到基于CRISPR/cas9的全基因组功能丧失筛选数据中。结果显示,SMAD4作为被鉴定为潜在GATA2相互作用物的10个蛋白中唯一的转录因子,是PCa细胞存活的必需基因,这表明GATA2和SMAD4之间的潜在相互作用可能对PCa细胞生长和肿瘤进展具有重要的功能。
构建Flag-GATA2表达载体,分析其在293T细胞中与SMAD家族成员(SMADs)的相互作用。结果显示SMAD4与GATA2结合最强。Flag-GATA2和V5-SMAD4在293T细胞中异位表达,并用Flag抗体进行免疫沉淀,沉淀中明显检测到SMAD4。反过来,当用V5抗体免疫沉淀时,也可以在沉淀物中检测到GATA2。为了进一步证明它们是否在PCa细胞体内相互作用,进行了内源性的Co-IP实验,发现在培养的LNCaP细胞中GATA2和SMAD4确实存在相互作用(图4b)。为了测试GATA2是否直接与SMAD4相互作用,进行了GST下拉实验,证实了在1F5细胞中GATA2与SMAD4之间存在直接相互作用(图4c)。接下来,排除DNA或RNA介导相互作用的可能性,因此在拉下实验之前使用核酸酶来消化DNA和RNA。与未处理组相比,在Benzonase处理下,仍然观察到GATA2与SMAD4之间持续的直接相互作用(图4c)。对GATA2和SMAD4全基因组结合位点的ChIP-seq分析显示,在1F5细胞中,超过65%(4795/7321)的SMAD4染色质相关区域被GATA2共同占据(图4d)。
为了揭示GATA2和SMAD4在PCa中合作和功能的机制,分别在siRNA介导的GATA2和SMAD4敲低的1F5细胞中进行了转录组全RNA测序。近50%的SMAD4靶向基因被GATA2共同调节(图4e)。GSEA确定了GATA2和SMAD4之间超过40%的共同富集途径(图4f)。GATA2和SMAD4共同调节涉及多种癌症促进途径的基因表达,特别是肿瘤侵袭和转移所需的TGF-β信号(图4g)。GSEA富集图进一步表明,这些功能通路促进细胞增殖、上皮-间质转化(EMT)和凋亡在前列腺癌细胞中,GATA2或SMAD4靶向的上调基因在转移中高度富集(图4h,i)。为了评估这些发现是否具有临床影响,在几个独立的PCa患者肿瘤队列中进行了这些途径与GATA2或SMAD4表达的相关性,发现GATA2或SMAD4表达水平分别与EMT评分(图4k)和TGFβ信号传导评分(图41)显著正相关。综上所述,GATA2和SMAD4在体外和体内均表现出相互作用,并且与全基因组染色质结合和PCa基因表达相关,从而调节已知的驱动癌细胞增殖和转移的常见致癌途径。
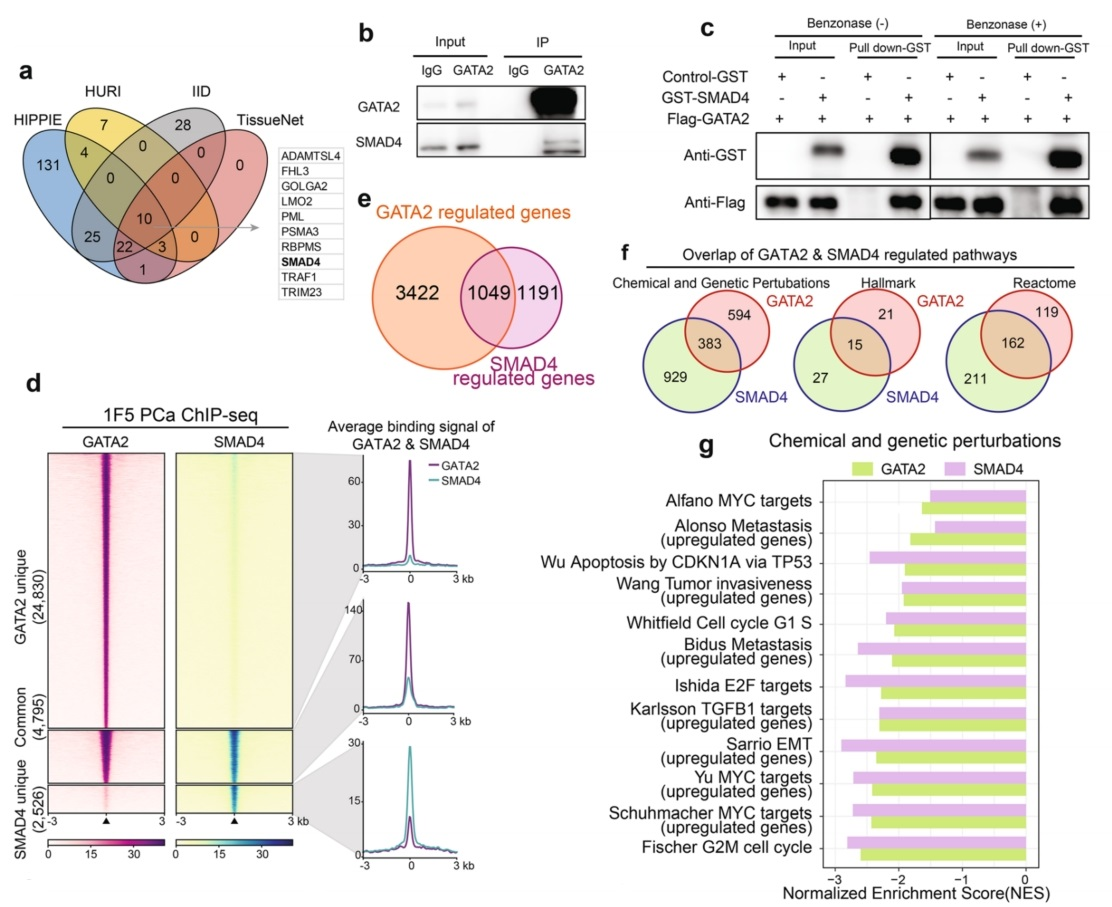
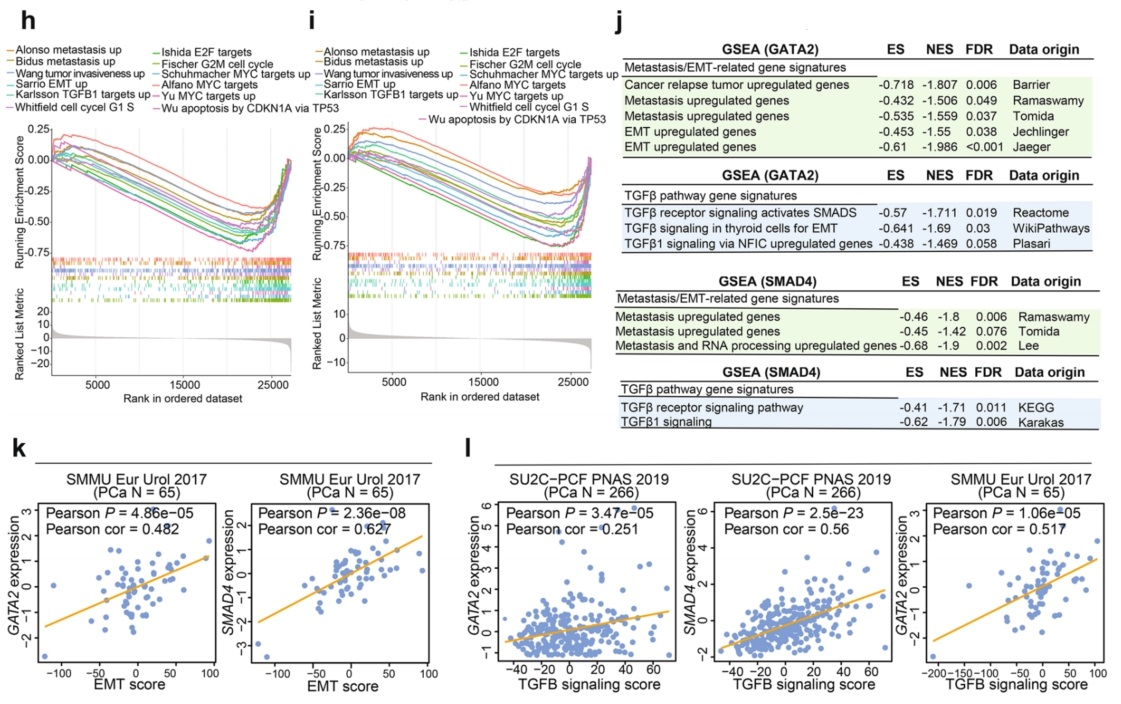
图4 GATA2与SMAD4相互作用,共同调控PCa基因和癌症转移途径
5、GATA2与SMAD4相互作用并合作,促进TGFβ1信号传导
鉴于TGF β信号通路通常在GATA2和SMAD4调控基因中富集,研究了TGFβ信号通路是否参与GATA2介导的PCa细胞迁移。因此,用TGFβ途径抑制剂LY2157299(LY)处理1F5-GATA2、22Rv1-GATA2和V16A-GATA2细胞,并在指定的时间点通过伤口愈合试验监测细胞的实时迁移。如图5a-c所示,过表达GATA2促进了PCa细胞的迁移,而经LY处理后,GATA2引起的相对伤口密度减少,这表明TGFβ信号确实参与了GATA2促进的细胞迁移。
为了深入了解GATA2可能直接调控的关键TGF-β通路基因的调控,进行了qRT-PCR。结果显示,下调GATA2特异性且持续地减弱TGFβ1的mRNA表达(图5d),但不影响其他TGFβ信号配体和受体基因的mRNA表达(图5a-e)。现已证实,p-SMAD2/3水平的升高标志着TGFβ1信号通路的激活。与发现GATA2积极调节TGFβ1表达的功能一致(图5d),Western blotting结果表明,GATA2的敲低导致p-SMAD3水平明显降低(图5e、f),而GATA2过表达则显著促进TGFβ1和p-SMAD2/3水平的表达(图5g-l)。此外,为了测试GATA2是否可以驱动TGFβ-SMAD信号响应性,使用了一种荧光素酶报告基因,其中包含SMAD结合位点(SBE4)的四个拷贝,已知这些位点被SMAD4激活。发现GATA2比SMAD4更能强烈诱导报告基因活性,当GATA2和SMAD4共表达时,SBE4驱动的荧光素酶活性显著增强(图5m)。用TGFβ1重组蛋白处理细胞。如图5所示,TGFβ1进一步增强了GATA2-和SMAD4导向的报告基因活性,但对GATA2激活SBE4的影响不大,这表明GATA2与SMAD4相互作用并协同促进了PCa中TGFβ1的信号传导。在人PCa肿瘤中,GATA2和SMAD4的表达水平与TGF-β信号转导活性高度相关(图5n-q),进一步证实了GATA2与SMAD4合作可能在临床环境中增强PCa细胞中的TGF-β信号转导。
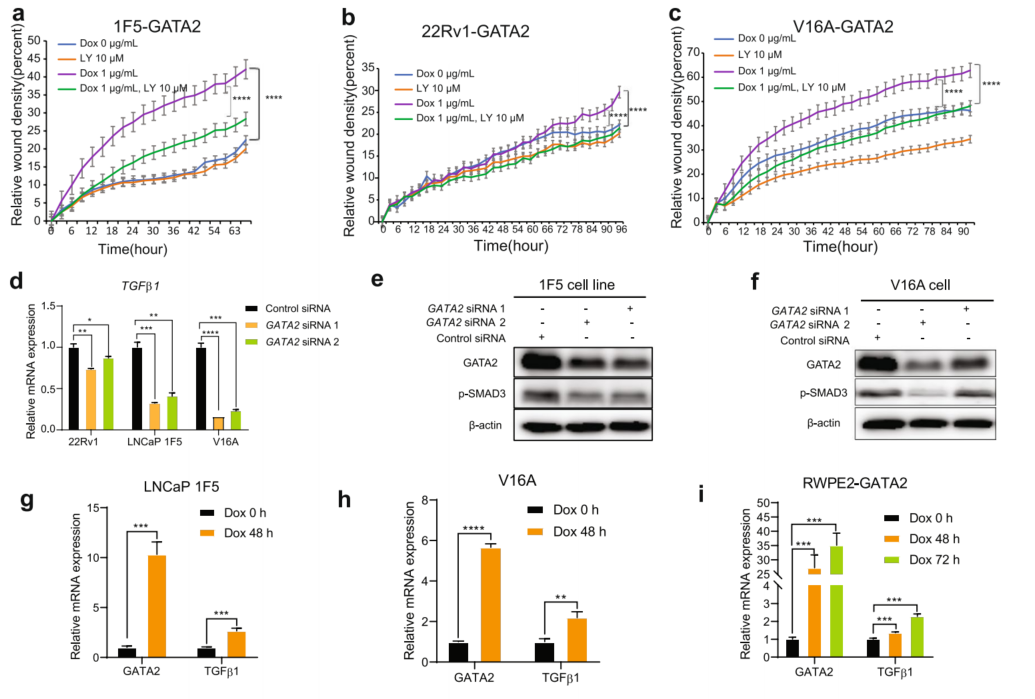
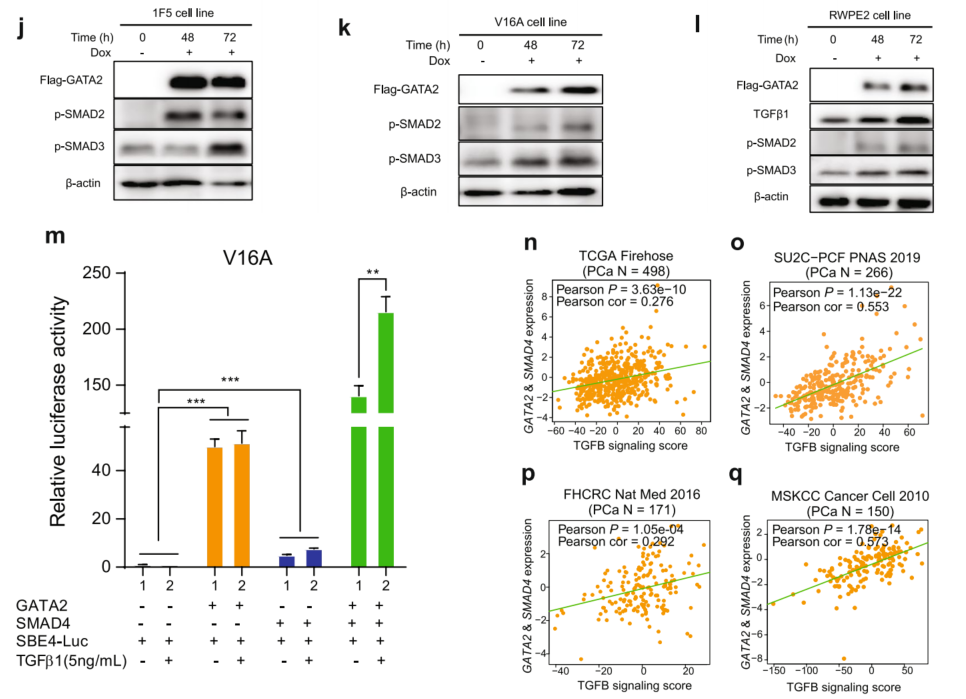
图5 GATA2与SMAD4合作促进TGFβ1信号传导
6、GATA2直接与TGFβ1的远端增强子结合,并调节PCa细胞中TGFβ1的表达
由于GATA2正向调控TGFβ1的表达(图5d、g-h),接下来研究TGFβ1是否是GATA2的直接靶基因。为了验证这一假设,启动子荧光素酶报告基因实验在V16A细胞中观察到GATA2地刺激了TGFβ1启动子的活性(图6a)。接下来,通过分析了不同PCa细胞模型的GATA2 ChIP-seq数据,发现在TGFβ1基因启动子上游约180kb处有一个很强的GATA2结合位点(图6b)。通过ChIP-qPCR证实了GATA2在PCa细胞系LNCaP、22Rv1和VCaP中分别与该位点结合(图6c)。为了探索GATA2结合位点与TGFβ1启动子区之间是否存在直接的染色质相互作用,观察PCa细胞LNCaP的Hi-C数据,发现两个区域之间可能存在远程相互作用(图6d)。进一步使用Hind III酶进行了定量染色体构象捕获测定(3C-qPCR)。结果表明,该GATA2结合位点在PCa细胞22Rv1中具有较高的交联频率(图6e)。在证实了TGFβ1上游的远端GATA2结合位点可以在PCa细胞中与TGFβ1促进区形成染色质相互作用后,进一步研究了假设的增强子是否直接调节TGFβ1的表达。使用功能性CRISPR/Cas9,挑选了三个删除了GATA2的结合位点的独立克隆。GATA2结合位点的缺失大大降低了TGFβ1 mRNA和蛋白的表达以及p-SMAD3在PCa细胞中的丰度,表明在敲除该GATA2结合位点后TGFβ信号减弱(图6f、g)。最后,通过Kaplan-Meier生存分析,发现TGFβ1表达水平较高的肿瘤的人类PCa患者生化复发和转移的可能性明显增加(图6h、i)。以上结果证明GATA2结合TGF-β1上游增强子促进其表达,进而激活TGF-β1信号通路,促进PCa的进展。
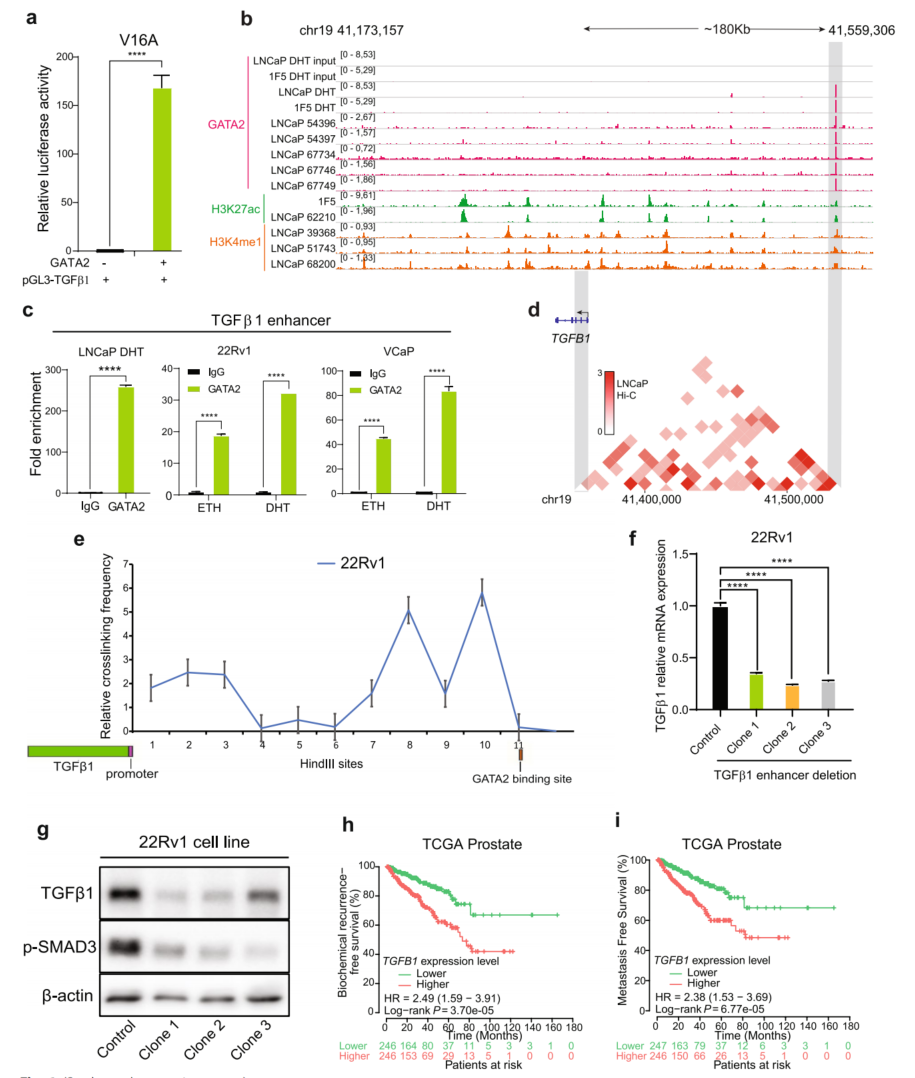
图6 GATA2与TGFβ1的远端增强子结合,并调节PCa细胞中TGFβ1的表达。
7、GATA2与SMAD4共同调控AR信号通路和PCa风险基因
先前有报道称,GATA2对AR表达和适当的转录活性至关重要。因此,推断AR信号可能参与调节GATA2诱导的PCa细胞侵袭。分别用AR拮抗剂恩杂鲁胺(Enzalutamide,Enz)处理1F5、V16A和22Rv1细胞,Enz显著降低了GATA2过表达驱动的细胞迁移(图7a-c)。GATA2和SMAD4的联合表达水平与多个独立临床PCa数据集的AR信号评分显著相关(图7d)。为研究GATA2和SMAD4直接靶基因是否与PCa中的AR信号传导有关,对1F5 PCa细胞中GATA2或SMAD4敲低的转录组数据和ChIP-seq数据综合分析,从而得出41个GATA2和SMAD4的直接靶基因(图7e,上图)。AR靶向基因KLK3在GATA2敲低时下调最显著,在KLK3的上游增强子处GATA2和SMAD4的染色质结合很强(图7e,下图)。在SMAD4敲低之后KLK3下调。鉴于在PCa患者肿瘤中GATA2和SMAD4与AR信号正相关(图7d),下一步研究GATA2和SMAD4直接作用靶点基因是否与AR信号通路相关。事实上,该分析在多个独立的PCa队列中显示了显著的线性正相关性(图7f)。
前列腺癌是一种最具遗传性的癌症,全基因组关联研究(GWAS)已经发现了前列腺癌风险或侵袭性相关的非编码变异,通常通过调节转录因子-DNA结合来调节基因表达(eQTL)。结合GWAS鉴定了PCa风险单核苷酸多态性(SNP)位点,并检索了它们在紧密连锁不平衡中的代理SNP(LD,R2≥0.5),并计算了多个PCa细胞系中GATA2或SMAD4 ChIP-seq峰中这些含SNP区域的富集程度。接下来,从GTEx、PancanQTL和ncRNA-eQTL这三个eQTL数据集中确定了与富集在GATA2或SMAD4结合位点的SNP相关的eQTL基因(eGenes),并揭示了受GATA2或SMAD4影响的十几个eGenes。KLK3被鉴定为一个eGene,GATA2和SMAD4的染色质占据覆盖了包含其eQTL SNP区域。(图7e),因此根据PCa中综合的多层遗传和基因组数据,它被定义为一个直接靶基因和一个eGene。qRT-PCR分析进一步证实,敲低GATA2或SMAD4分别降低了1F5和V16A细胞中AR信号靶向基因KLK2和KLK3的mRNA表达水平(图7g、h)。总的来说,这些数据表明GATA2与SMAD4共同调节PCa中的AR信号以及遗传上定义的PCa风险或侵袭性相关基因。
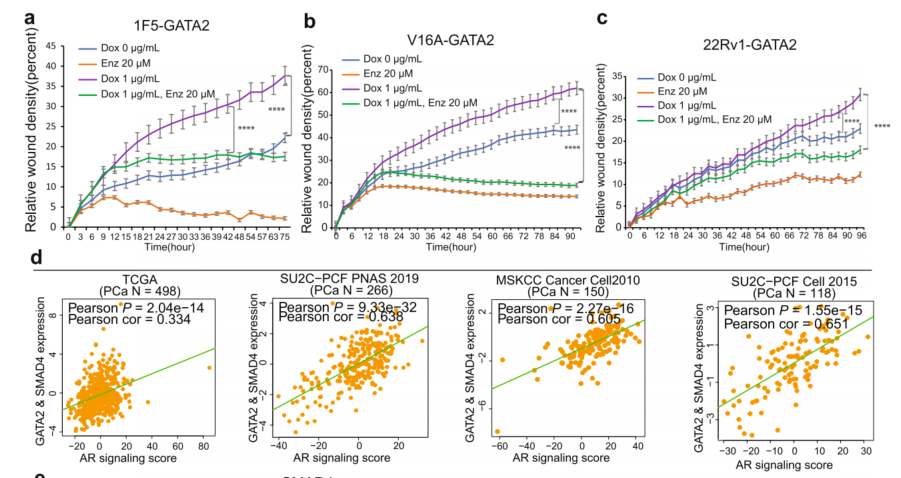
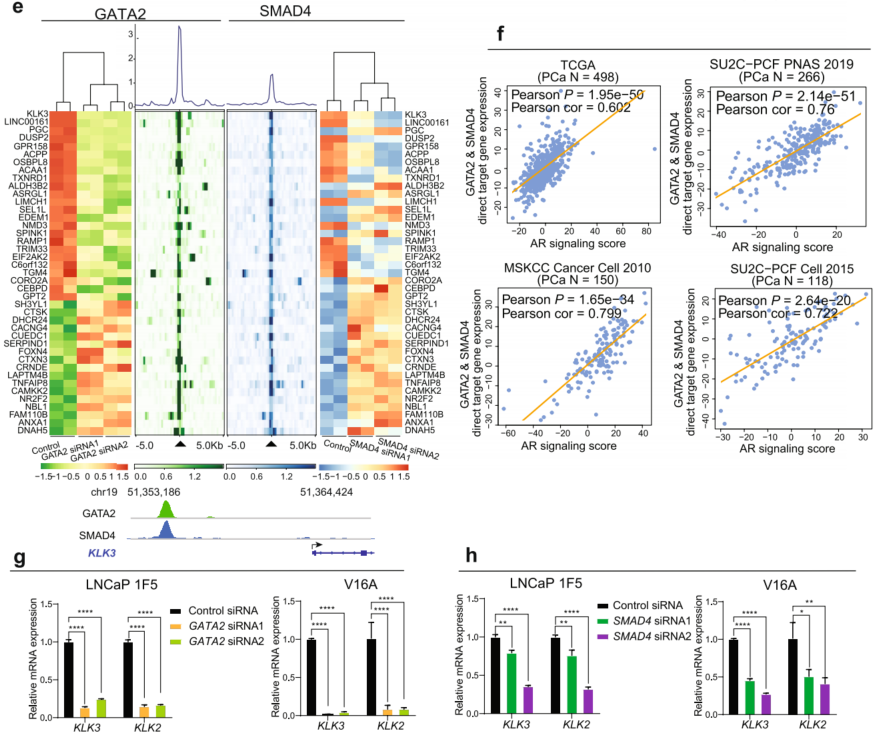
图7 GATA2与SMAD4共同调节AR信号
8、GATA2和SMAD4对前列腺癌(PCa)风险关联具有全局性影响,并与HOXB13形成转录复合体以驱动位于6q22的前列腺癌风险基因RFX6的表达
接下来研究了GATA2和SMAD4对PCa遗传易感性的影响。分别计算了GATA2单独结合区、GATA2和SMAD4共同结合区以及SMAD4单独结合区PCa风险SNP的富集程度。有趣的是,发现PCa风险SNP在GATA2和SMAD4的共同结合位点上比它们单独的对应位点更丰富(图8a)。然后,提取了富集的风险SNP,并整合了多来源的eQTL数据,定义了一个详细的locus-SNP-eGenes关联Circos图谱(图8b),确定了GATA2、SMAD4和6q22的PCa易感位点之间的潜在功能关联,其中包含GWAS报道的rs339331变体。之前证明转录因子HOXB13更倾向于与风险相关的T等位基因rs339331结合,导致RFX6的表达增加,并可能参与PCa的发病机制。本文中,在rs339331含区观察到的GATA2和SMAD4的染色质结合(图8c)促使探索rs339331的变异是否可能调节更复杂的转录因子复合体,不仅包括HOXB13,还包括GATA2和SMAD4,从而加在一起改变RFX6的表达。
接下来,通过生物信息学预测,以检查rs339331变异对转录因子DNA结合的直接影响,并发现GATA2倾向于与PCa风险相关的rs339331的T等位基因结合(图8c)。ChIP-qPCR证实了在PCa细胞22Rv1(图8d)中含有rs339331的区域明显富集了GATA2和SMAD4。ChIP-qPCR,发现GATA2、SMAD4和HOXB13都比rs339331的C等位基因优先结合T等位基因(图8e和图8c)。与此相一致的是,Sanger测序结果也显示,GATA2、SMAD4和HOXB13的ChIP DNA中rs339331 T等位基因区域也高于input DNA(图8f)。rs339331基因型与PCa患者预后无关。鉴于rs339331的风险等位基因与RFX6高表达相关,且RFX6上调与PCa进展相关,进一步rs339331与RFX6表达状态是否协同影响PCa预后。在rs339331位点携带纯合风险基因型TT且RFX6表达水平较高的肿瘤的PCa患者与生化复发和转移的风险增加密切相关(图8g,i)。相反,发现与RFX6表达水平较低的肿瘤的PCa患者没有关联(图8h,j)。因此,这些结果表明,携带rs339331风险等位基因TT的前列腺癌患者,肿瘤中表达较高水平的eQTL基因RFX6与前列腺癌预后不良相关。
之前报道了一种新的基因调控机制,其潜在的风险是改变三元转录因子复合物的SNP位点,但调控蛋白如何在含SNP区域分层形成仍不清楚。为了验证这一点,进一步研究了GATA2、SMAD4和HOXB13是否可以相互影响它们在rs339331含区的结合,从而建立了shRNA介导的每个因子的敲低稳定细胞系。siRNA介导的GATA2或SMAD4的下调降低了RFX6的表达水平(图8k,1),表明rs339331基因RFX6是GATA2和SMAD4的直接靶点。
接下来,在临床环境中研究了RFX6与GATA2表达之间的相关性,并在多个独立的PCa数据集中观察到GATA2与RFX6之间存在显著的线性正表达相关性(图8m,n)。GATA2在预测PCa患者的生存方面具有预后价值(图1g,h,o-q)。并且之前的研究表明RFX6对PCa的进展具有临床影响,因此进一步分析RFX6与GATA2是否在临床PCa预后方面具有更好的协同作用。Kaplan-Meier生存分析显示,肿瘤表达较高水平RFX6和GATA2的PCa患者与生化复发和转移的风险增加相关(图8o、p)。生存分析显示RFX6和GATA2联合表达水平对Gleason评分为7的患者的生化复发和转移具有预测价值,但对较低(Gleason评分为6)或较高(Gleason评分为8)的个体没有预测价值(图8q、r)。这些发现表明,RFX6和GATA2在临床环境中对PCa具有优越的协同预测价值。
在证实TGFβ/SMAD通路抑制剂LY会损害GATA2诱导的PCa细胞生长和侵袭性(图5a-c),以及之前的一项研究表明GATA2抑制剂K7174会阻断GATA2向转录靶基因的募集后,试图检验GATA2和SMAD4调控的eQTL基因是否可以成为PCa的潜在治疗靶点。因此,用LY、K7174或它们的组合处理LNCaP 1F5细胞(图8s)。qRT-PCR分析显示,联合使用GATA2抑制剂K7174和TGFβ/SMAD信号抑制剂LY确实降低了6q22 RFX6和19q13.33 KLK3基因的表达水平(图8s)。接下来,发现K7174和LY对其他eQTL基因也有类似的协同作用,这表明鉴定的eQTL基因及其上游信号通路和转录因子在PCa中的潜在临床应用。

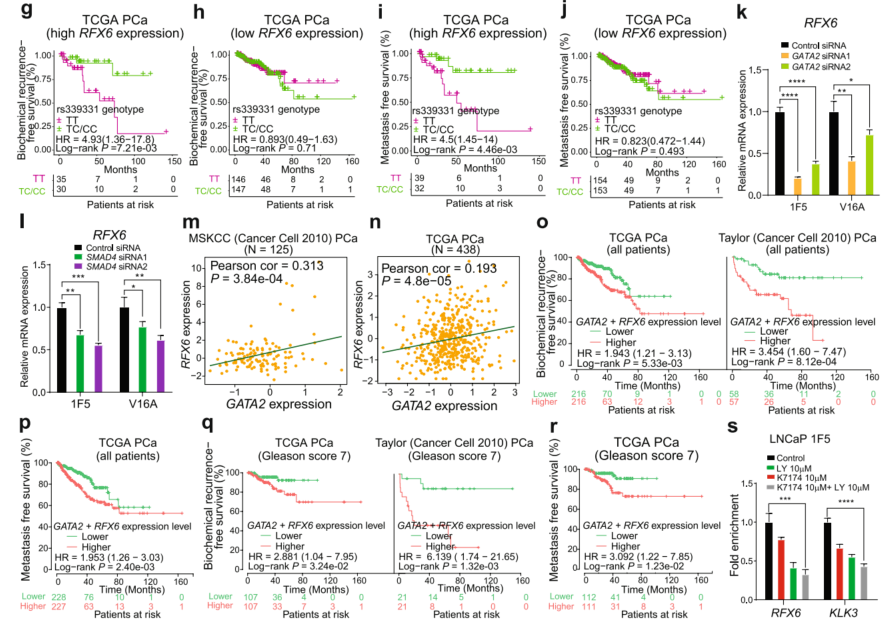
图8 GATA2与SM33931/6q22增强子rs339331和HOXB13形成转录复合物,驱动PCa风险基因RFX6的表达
三、研究结论
GATA2的扩增和上调与前列腺癌转移相关,GATA2与SMAD4相互作用,并且GATA2直接与TGFβ1的远端增强子结合,协同增强TGFβ和AR信号通路。并与HOXB13在PCa风险相关的rs339331/6q22增强子上形成转录复合物,导致PCa易感基因RFX6的表达增加。
参考文献:
GATA2 co-opts TGFβ1/SMAD4 oncogenic signaling and inherited variants at 6q22 to modulate prostate cancer progression.[J]Journal of Experimental &Clinical Cancer Research, 2023.