| 时间:2024-07-05 |
2023年发表于《International Journal of Biological Sciences》(IF =9.2)
一、研究背景
卵巢癌是世界上最常见的三大妇科恶性肿瘤之一。由于其高复发率和预后差,其致死率一直是最高的。此外,卵巢癌通常诊断较晚,无有效的筛查策略。
很多研究表明表观遗传修饰在肿瘤发展过程中起到关键作用。在大多数真核生物中,m6A被认为是最常见的一种RNA修饰。作为一个动态可逆的过程,几乎在所有生物过程中起着重要的作用,包括干细胞的分化、组织的发育和癌症的进展。m6A是由m6A甲基转移酶(METTL3,METTL14和WTAP)催化。由去甲基化酶FTO和ALKBH5催化发生去甲基化。m6A识别蛋白(YTHDC1、YTHDC2和YTHDF1-3)可识别并结合m6A基序,调节RNA剪接、翻译、核输出和RNA稳定性。不同的识别蛋白会导致m6A修饰在不同的情况下发挥致癌或抑制肿瘤的作用。然而,m6A在卵巢癌中的生物学功能及其潜在的调控机制尚不完全清楚。
在本研究中,旨在揭示m6A修饰及识别蛋白YTHDC1在调节卵巢癌进展中的功能。结果表明,YTHDC1过表达在体内和体外均能抑制卵巢癌的进展,YTHDC1以m6A依赖的方式结合并稳定PIK3R1,并通过STAT3信号通路进一步抑制GANAB介导的N-聚糖生物合成。因此,认为YTHDC1可能在卵巢癌进展中发挥肿瘤抑制因子的重要作用,这为卵巢癌的靶向治疗提供了新的思路。
二、研究结果
1、YTHDC1在卵巢癌中低表达
为了研究m6A识别蛋白YTHDC1在卵巢癌进展中的潜在作用,首先分析了YTHDC1在卵巢癌中的表达水平。使用GEPIA和Oncomine数据库进行的分析显示,与卵巢正常组织相比,YTHDC1在卵巢癌组织中的表达明显降低(图1A-B)。此外,GEO数据集还证实,与原发性卵巢癌相比,YTHDC1 mRNA在卵巢癌中显著下调(GSE36668,图1C右),在腹水卵巢癌中低表达(GSE73168,图1C左)。卵巢癌组织中YTHDC1的RNA和蛋白水平明显低于卵巢良性组织(图1D-E)。此外,通过免疫组化染色观察到,与人类良性卵巢组织相比,卵巢癌组织中YTHDC1蛋白水平明显降低(图1F-G)。以上结果说明m6A识别蛋白YTHDC1在卵巢癌中低表达。

图1 在卵巢癌中YTHDC1的表达水平降低
2、YTHDC1的低表达可加速卵巢癌的进展
为在体外和体内评估YTHDC1在卵巢癌中的功能,首先建立了稳定过表达YTHDC1的卵巢癌细胞系(OE-YTHDC1)(图2A)。EdU和CCK-8检测显示,上调YTHDC1可显著抑制卵巢癌细胞的生长(图2B-D)。此外,通过集落形成实验发现,过表达YTHDC1后,克隆原性受到抑制(图2E-F)。此外,通过transwell实验发现,YTHDC1过表达会损害A2780、SKOV3和OVCAR3细胞的迁移(图2G-H)和侵袭(图2I-J)能力。然而,与上述结果相反,下调YTHDC1可显著促进卵巢癌细胞的增殖、迁移和侵袭。
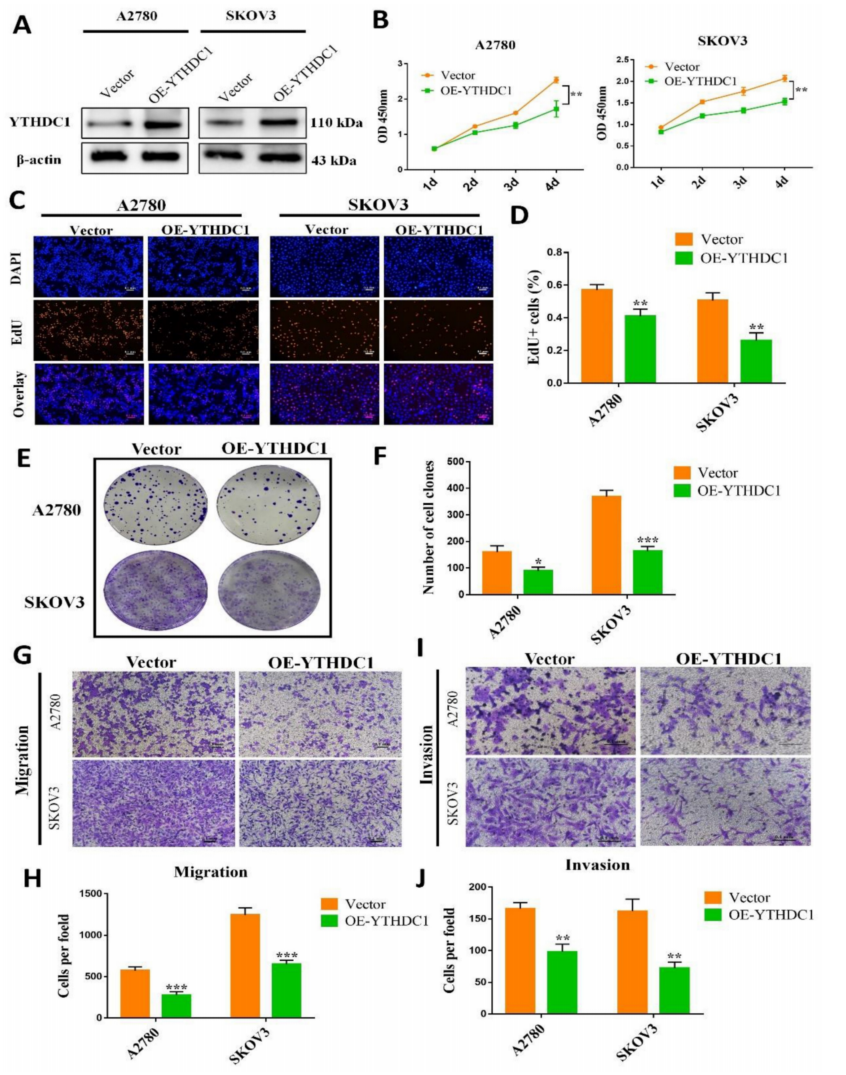
图2 YTHDC1的过表达可抑制卵巢癌的发生发展
为了研究YTHDC1在体内卵巢癌模型中的致瘤特性,将对照细胞以及过表达YTHDC1的SKOV3和OVCAR3细胞皮下注射到裸鼠体内。4-6周后,与对照组相比,YTHDC1上调可显著抑制肿瘤生长(图3A-B)。此外,IHC染色显示,YTHDC1过表达增强了caspase-3的活性,但降低了肿瘤区域的Ki-67信号传导(图3C-E)。总之,这些发现证实了YTHDC1在体外和体内抑制卵巢癌进展中的重要功能。
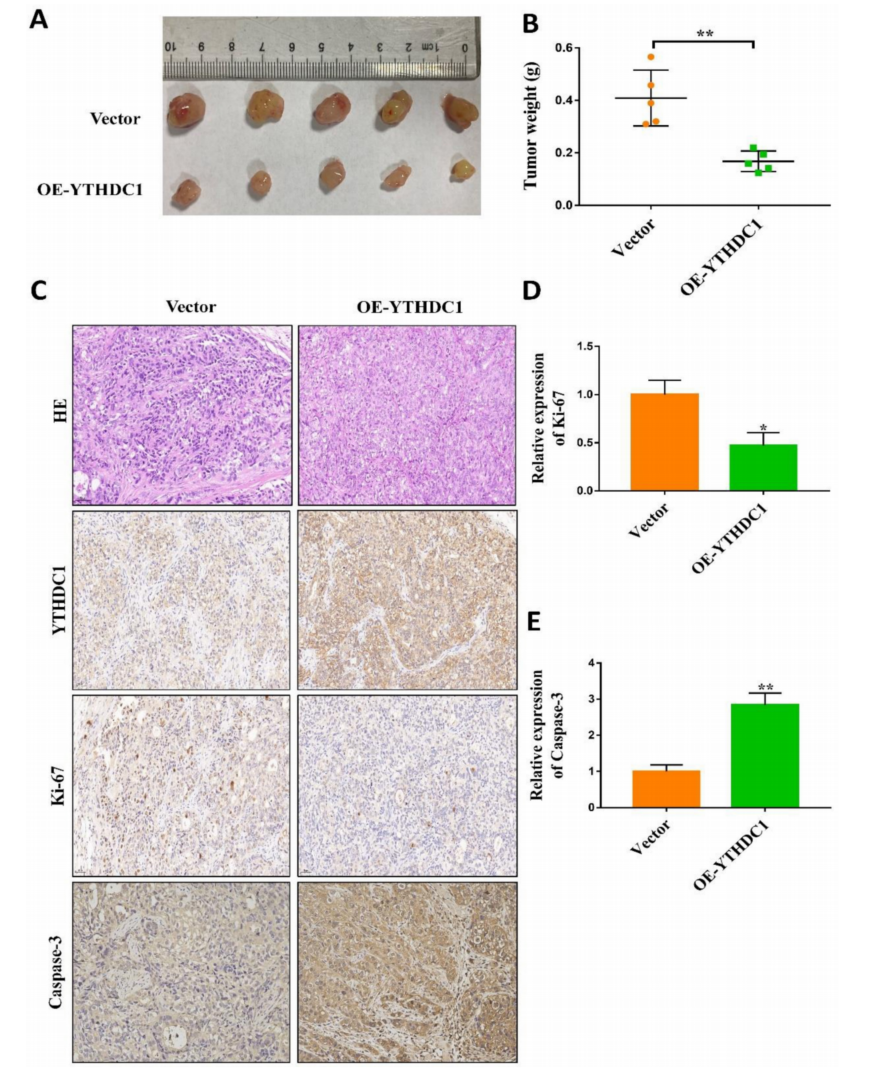
图3 YTHDC1过表达抑制体内肿瘤发生
3、卵巢癌中YTHDC1潜在靶点的鉴定
对YTHDC1敲低的SKOV3和A2780细胞进行RNA-seq分析,进一步研究YTHDC1在卵巢癌进展中的潜在分子机制。YTHDC1敲低共产生106个差异表达基因,其中56个基因上调,50个基因下调;KEGG富集分析显示AGE-RAGE信号通路、胆碱能突触、N-聚糖生物合成等是富集最多的20条通路(图S4C)。
接下来,在SKOV3细胞中应用YTHDC1-RIP-seq鉴定直接结合YTHDC1的RNA。共鉴定出9522个YTHDC1的潜在靶点,其中86.39%为mRNA(图4A)。有研究表明,YTHDC1与m6A修饰的mRNA结合并保持其稳定性,因此,YTHDC1敲低导致其靶基因表达降低。有趣的是,有14个基因在RNA-seq(SKOV3和A2780中下调)和RIP-seq数据中重叠(图4B)。此外,GEPIA数据库分析显示,只有PIK3R1、JUNB、RHOBTB2和SLC25A37四个基因在卵巢癌中低水平表达,且与YTHDC1呈正相关(图4C-D)。
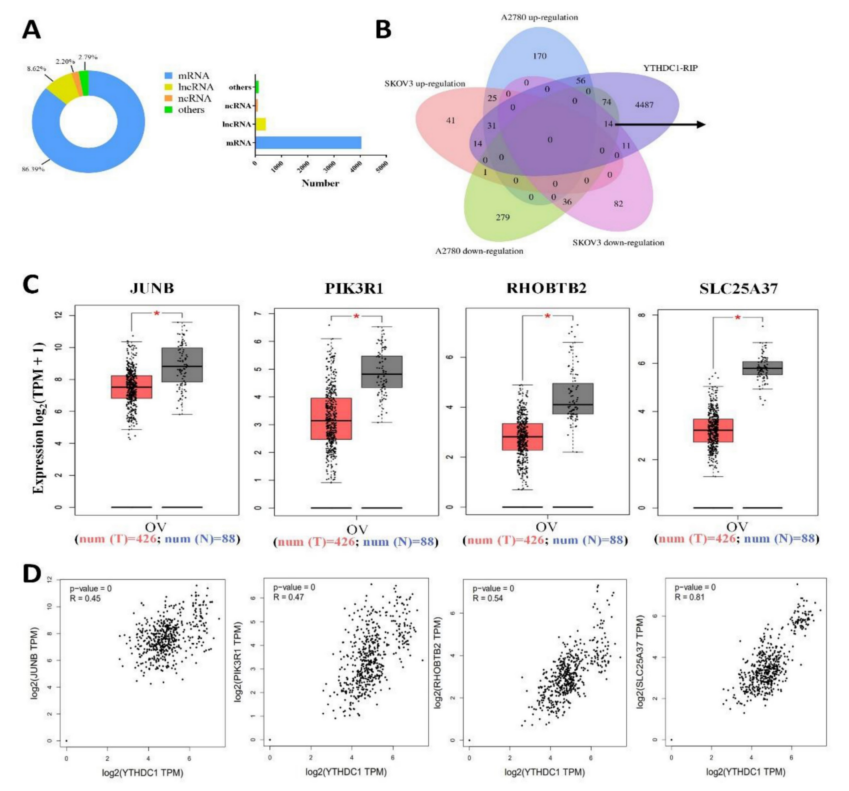
图4 卵巢癌细胞中YTHDC1靶点的鉴定
4、YTHDC1能够识别并结合PIK3R1 mRNA上的m6A修饰位点
为了进一步研究YTHDC1的靶向转录物,首先验证了上述四个候选基因在YTHDC1敲低的SKOV3和A2780细胞中的mRNA水平。结果表明,YTHDC1基因敲低后,4个基因均下调,其中PIK3R1下调最为显著(图5A-B)。在敲低YTHDC1后,PIK3R1蛋白水平显著降低(图6A)。同时,通过RIP-qPCR发现,YTHDC1蛋白PIK3R1 mRNA富集程度更高(图5C-D)。此外,通过MeRIP-qPCR评估了四个基因的m6A修饰水平,在PIK3R1中观察到最高的m6A修饰水平(图5E-F)。因此,选择PIK3R1作为YTHDC1的靶点,并进行了进一步的验证。
有趣的是,YTHDC1敲低后,RNA核质分离显示细胞质中PIK3R1显著降低,而细胞核中无显著差异(图5G-H)。因此,推测YTHDC1可能结合并稳定了细胞质中m6A修饰的PIK3R1 mRNA。假设YTHDC1是正向调控PIK3R1的mRNA水平,随后研究了YTHDC1是否会影响PIK3R1的稳定性。在指定时间用放线菌素-D处理SKOV3和A2780细胞,qRT-PCR显示YTHDC1敲低导致PIK3R1 mRNA稳定性显著降低(图6B)。为了确定YTHDC1是否通过m6A修饰与PIK3R1结合,设计了m6A甲基化酶的siRNA,包括METTL3、METTL14和WTAP,并分别转染到SKOV3和A2780细胞中。正如预期的那样,METTL3、METTL14和WTAP的表达显著降低(图S5)。如图6C-D所示,敲除METTL3和WTAP后,PIK3R1 mRNA明显减少。此外,化合物11,一种化学抑制剂,最近被报道在体外阻断YTHDC1和m6A之间的结合(图6E)。RIP-qPCR结果显示,化合物11降低了YTHDC1与PIK3R1 mRNA的结合,但YTHDC1蛋白或m6A甲基化酶的表达没有改变(图6F-G)。此外,敲除METTL3后,YTHDC1与PIK3R1 mRNA的结合明显减少。通过免疫组化染色进一步检测卵巢癌组织中PIK3R1蛋白水平。令人惊讶的是,与卵巢初始组织相比,卵巢癌组织中PIK3R1的表达水平明显降低(图6H)。总之,这些结果表明PIK3R1是卵巢癌中YTHDC1的直接靶点。
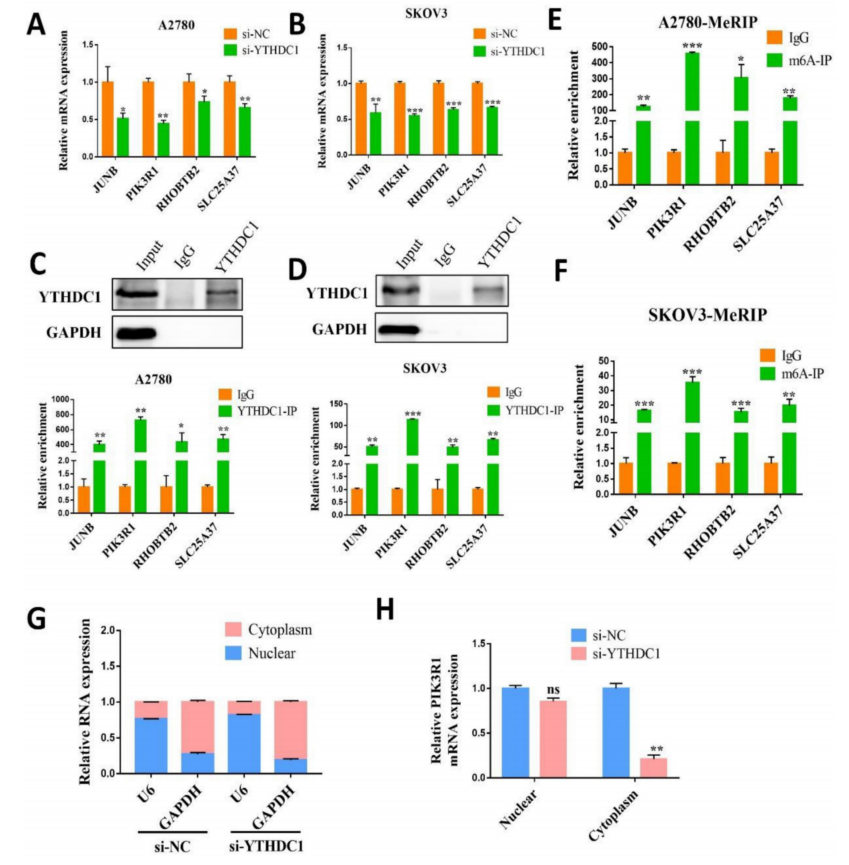
图5 YTHDC1在卵巢癌细胞中靶向PIK3R1
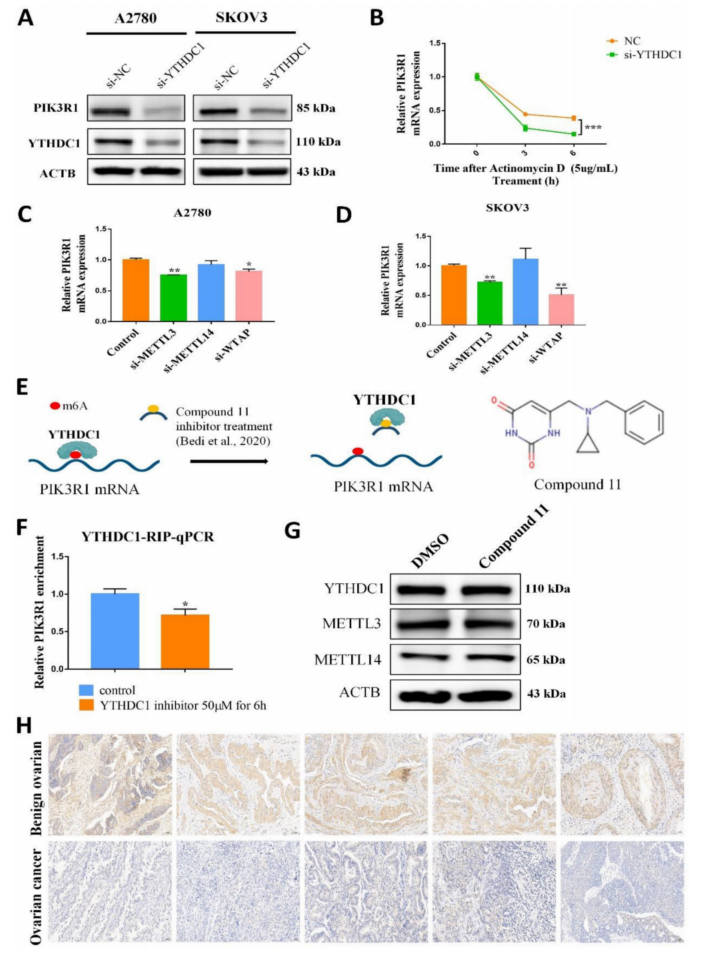
图6 YTHDC1能够识别并结合PIK3R1 mRNA m6A位点,并保持其稳定性
5、卵巢癌细胞中PIK3R1的异位表达抑制了YTHDC1缺失对肿瘤促进作用
通过在YTHDC1缺失的SKOV3和A2780细胞中过表达PIK3R1,进一步探索PIK3R1在卵巢癌中的作用(图7A)。CCK-8、EdU和集落形成实验的结果表明,PIK3R1过表达可以对YTHDC1缺乏诱导的细胞增殖和集落形成能力的增加产生逆转作用(图7B-F)。transwell实验得到了一致的结果,YTHDC1敲低促进细胞迁移和侵袭,PIK3R1过表达后细胞迁移和侵袭得到改善(图7G-J)。此外,在体内,过表达PIK3R1可显著抑制shYTHDC1诱导的卵巢癌肿瘤生长。因此,数据表明PIK3R1是YTHDC1抑制卵巢癌进展的关键下游靶点。
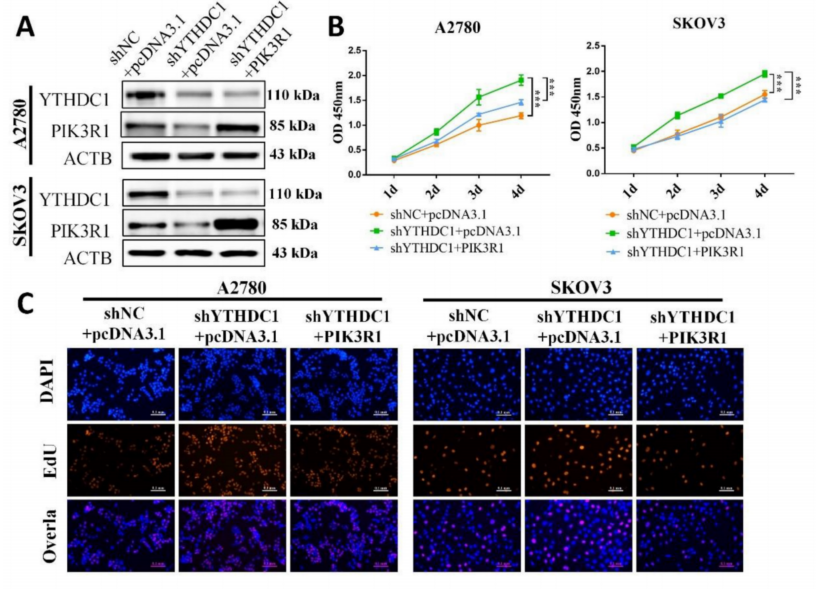
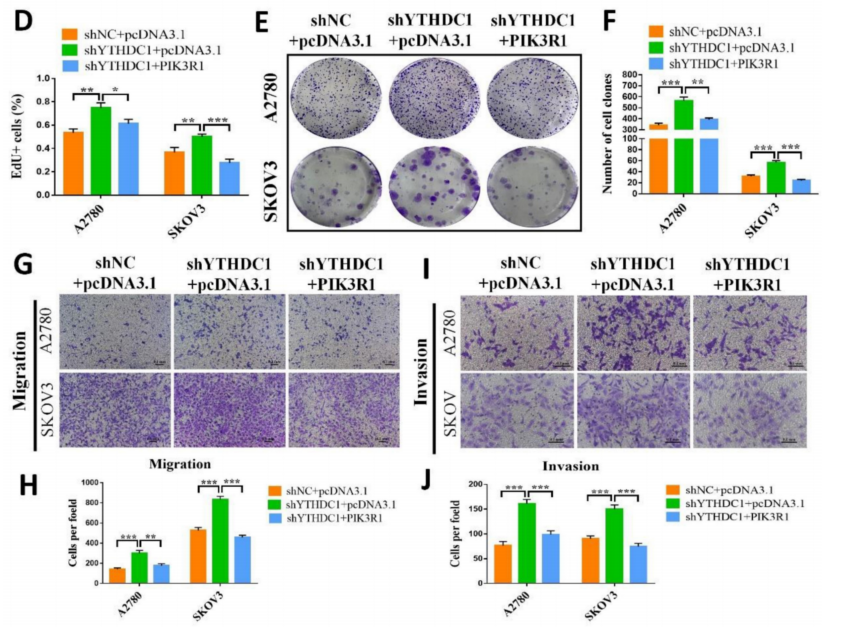
图7 YTHDC1的低表达通过下调PIK3R1加速卵巢癌的恶性进展
6、YTHDC1缺失通过PIK3R1激活的GANAB表达增强卵巢癌中N-聚糖的生物合成
RNA-seq数据显示,N-聚糖的生物合成参与了YTHDC1敲低的卵巢癌发展过程(图4C)。因此,研究了YTHDC1是否调节N-聚糖的生物合成从而影响卵巢癌的进展。火山图显示,在YTHDC1敲低后,与N-聚糖生物合成途径相关的GANAB的表达明显上调(图8A)。然后,qRT-PCR和western blot分析显示,尽管YTHDC1敲低后SKOV3和A2780细胞中GANAB的表达显著增加,但这些影响被PIK3R1过表达逆转(图8B-C和8F-G)。此外,在SKOV3和A2780细胞中,PIK3R1敲低后,GANAB的蛋白和mRNA水平显著上调(图8D-E),表明GANAB是PIK3R1的下游因子。考虑到GANAB是参与N-聚糖生物合成的关键酶,对SKOV3和A2780细胞进行了凝集素荧光组织化学分析。如图8H所示,敲低YTHDC1或PIK3R1后,PHA-E+L和PHA-E识别的复合物型N-聚糖和二分GlcNAc的表达水平升高。这些结果表明,YTHDC1敲低通过上调GANAB的表达来增加N-聚糖的生物合成。
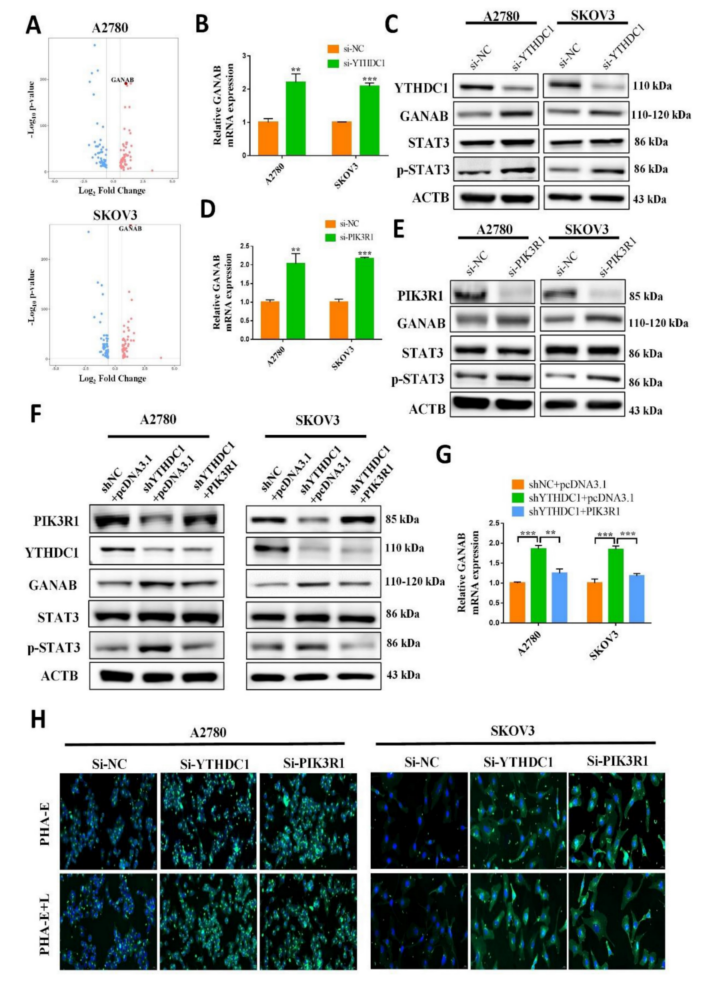
图8 YTHDC1缺失在卵巢癌细胞中通过PIK3R1-p-STAT3-GANAB轴增强N-聚糖的生物合成
7、YTHDC1通过PIK3R1-STAT3轴促进GANAB的表达
已经研究了PIK3R1上调GANAB表达的潜在机制。据报道,PIK3R1的缺失可以激活卵巢癌中AKT和STAT3信号通路。同样,在PIK3R1敲低后,SKOV3和A2780细胞中也观察到STAT3磷酸化增加(图8E)。此外,观察到YTHDC1敲低后p-STAT3蛋白水平升高,可以被PIK3R1的过表达逆转(图8C和8F)。如图S8所示,YTHDC1的敲低也导致STAT3从细胞质转位到细胞核。STAT3被认为是调控基因表达的主转录因子,因此假设PIK3R1通过激活STAT3信号通路促进GANAB的表达。
为解决上述问题使用在线数据库JASPAR,在GANAB启动子区域找到了两个一致的STAT3结合位点,评分>9.0(图9A)。为了验证这一点,进行了ChIP-qPCR,发现PIK3R1敲低后,STAT3在GANAB启动子处高度富集(图9B)。此外,STAT3敲除后GANAB蛋白水平降低,但这种影响被GANAB过表达逆转(图S9A)。同样,GANAB过表达有可能逆转STAT3缺乏引起的卵巢癌细胞增殖、迁移和侵袭能力的降低。接下来,研究了沉默GANAB是否会影响YTHDC1的敲低效果。结果,YTHDC1敲低显著促进了体内和体外卵巢癌的进展,GANAB敲低显著抑制了体内和体外卵巢癌的进展,然而,沉默GANAB消除了shYTHDC1诱导的肿瘤促进。正如预期的那样,GEPIA数据库分析显示GANAB和STAT3在卵巢癌中的表达呈正相关(图9C)。此外,GEO数据集证实GANAB mRNA水平在卵巢癌中升高(图9D),IHC染色也证实了这一点(图9E)。这些发现表明PIK3R1通过激活STAT3信号通路促进GANAB的表达。
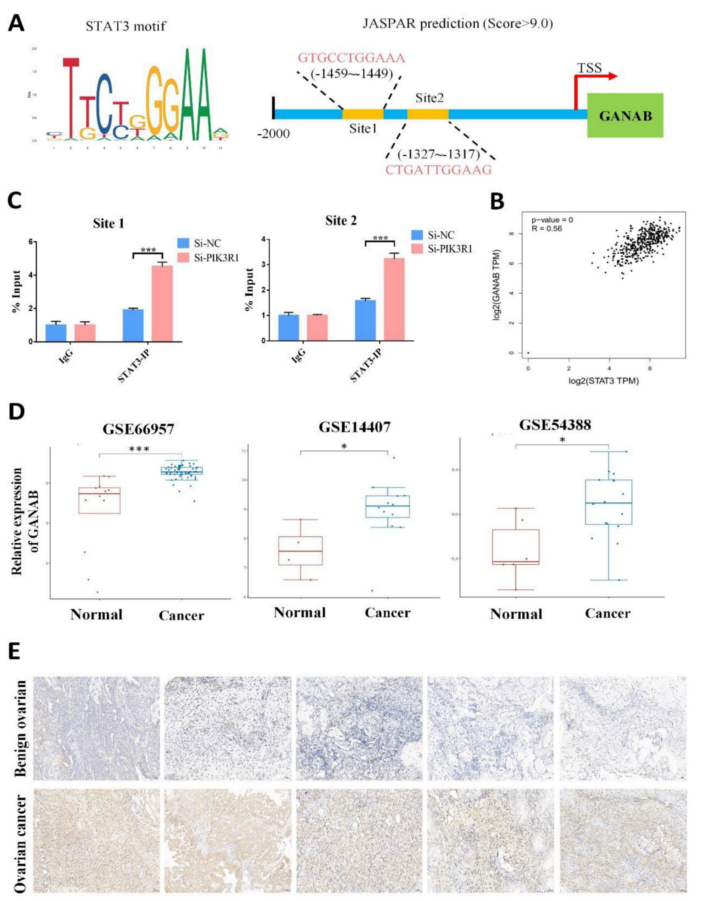
图9 STAT3通过直接与GANAB的启动子结合来激活GANAB的表达
三、研究结论
YTHDC1的过表达在体内和体外均可抑制卵巢癌的发展,PIK3R1是YTHDC1的直接靶点。YTHDC1以m6A依赖的方式增强PIK3R1的稳定性,随后通过STAT3信号传导抑制N-聚糖生物合成中GANAB的表达。YTHDC1可以作为一种潜在的预后生物标志物和治疗靶点。
参考文献:
Low expression of m6A reader YTHDC1 promotes progression of ovarian cancer via PIK3R1/STAT3/GANAB axis.[J]International Journal of Biological Sciences, 2023.