| 时间:2024-05-30 |
2021年发表于《CLINICAL CANCER RESEARCH》(IF =11.5)
一、研究背景
胰腺导管腺癌(PDAC)是人类最致命的癌症之一,与PDAC相关的基因KRAS、TP53、Smad4、CDKN2A等,作为治疗预测生物标志物的临床应用有限。对于多种实体肿瘤,研究表明患者对治疗反应的异质性在一定程度上是由肿瘤之间的分子差异决定的。为一些研究分析了PDAC的异质性,并确定了PDAC的转录亚型,它们与不同的分子通路有关。然而,有人质疑PDAC亚型分型的有效性,认为肿瘤样本中发现的正常胰腺组织和间质细胞的基因表达会影响分型的准确性。
PDAC具有致密的间质成分,约占肿瘤体积的60%-90%,PDAC中的间质在调节肿瘤的发生和向转移性疾病的进展中发挥作用。本研究中,对接受治疗的PDAC样本进行了激光捕获显微切割(LCM)和RNA-seq分析,以确定它们的癌症和间质特异性分子亚型。利用这些患者不同的临床结果,确定了一个与分子亚型无关的基因表达特征,该特征可预测术后生存率。此外,还开发了一种RNA-ISH分析来证明几个基因的临床应用,这些基因的失调与生存有关。
二、研究结果
1、PDAC患者肿瘤和间质特异性亚型的鉴定
选择69例未经治疗的PDAC肿瘤进行RNA提取和组织学分析。仔细评估了每个肿瘤样本的RNA质量和癌症组织含量,选取了28个适合LCM的样本(图1A)。分别收集癌细胞和邻近的间质细胞(图1B)。在进行RNA分离之前,LCM捕获的癌症和邻近间质的图像经过病理检查,弃掉纯度有问题的样本。最终,选取19个癌症样本及其匹配的相邻间质样本的用于RNA-seq。对着38个配对数据进行无监督分析后,将癌症和间质样本分为两个独立的分支(图1C)。两组之间的t检验确定了1226个显著基因(P<1%,Q<1%,FC>2x),预测癌症或间质区域的准确率为100%(图1D和E)。GO分析显示,这些肿瘤的癌细胞区域富含与上皮细胞形态发生、胆固醇和甘油三酯生物合成以及类固醇和维甲酸代谢有关的基因,而间质区域富含调节细胞外基质(ECM)、免疫反应和细胞黏附的基因。
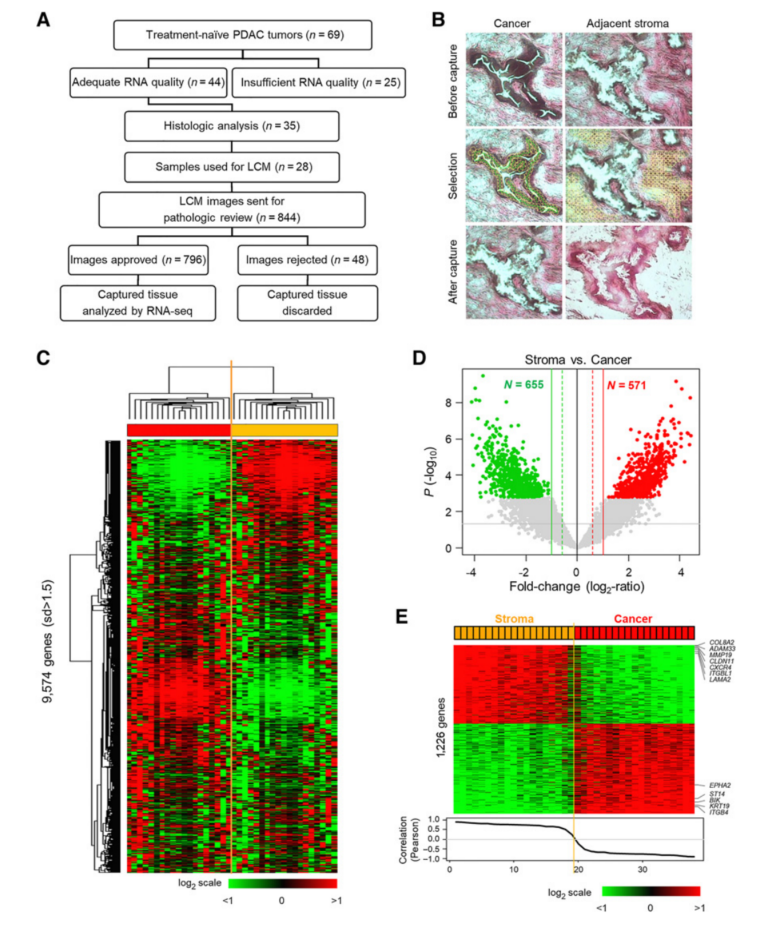
图1 PDAC肿瘤中癌细胞与邻近间质的基因表达差异
聚类分析确定了四种癌细胞亚型(C1-C4),这些亚型由209个基因表达特征决定(图2A)。为了确定与癌细胞相关的生物学过程,用来自MSigDB的注释基因表达集进行GSVA(图2B)。C1亚型与蛋白质折叠和白细胞趋化相关的基因有关,C2亚型与胰腺内分泌细胞发育和功能以及神经膜信号转导所需的基因程序有关,C3亚型与核苷酸生物合成和蛋白质翻译调节相关,C4亚型与致癌信号转导途径丰富的基因程序相关。
然后根据几个标准将这些分类与PDAC的三个主要分子分类(Bailey、Collisson和Moffitt)进行比较。交叉参考四个基因列表(Bailey:859个基因;Collisson:62个基因;Moffitt“肿瘤”:50个基因;本研究的癌症特异性亚型:209个基因)显示,来自LCM癌症特异性亚型的基因列表与其他分子分类之间的重叠有限。本研究LCM纯化的癌症亚型与先前使用包含癌症和间质细胞的混合的实体肿瘤定义的分子亚型之间存在很强的相关性。虽然彼此不同,但发现C1和C3亚型与经典/胰腺前体亚型有关,C2与ADEX/外分泌样亚型有关,C4与鳞状/基底样/准间充质亚型有关(图2C)。具有C4癌症特异性亚型的患者无病生存期最短(DFS;图2D),这与其与鳞状/基底细胞样/准间充质亚型的关系一致。
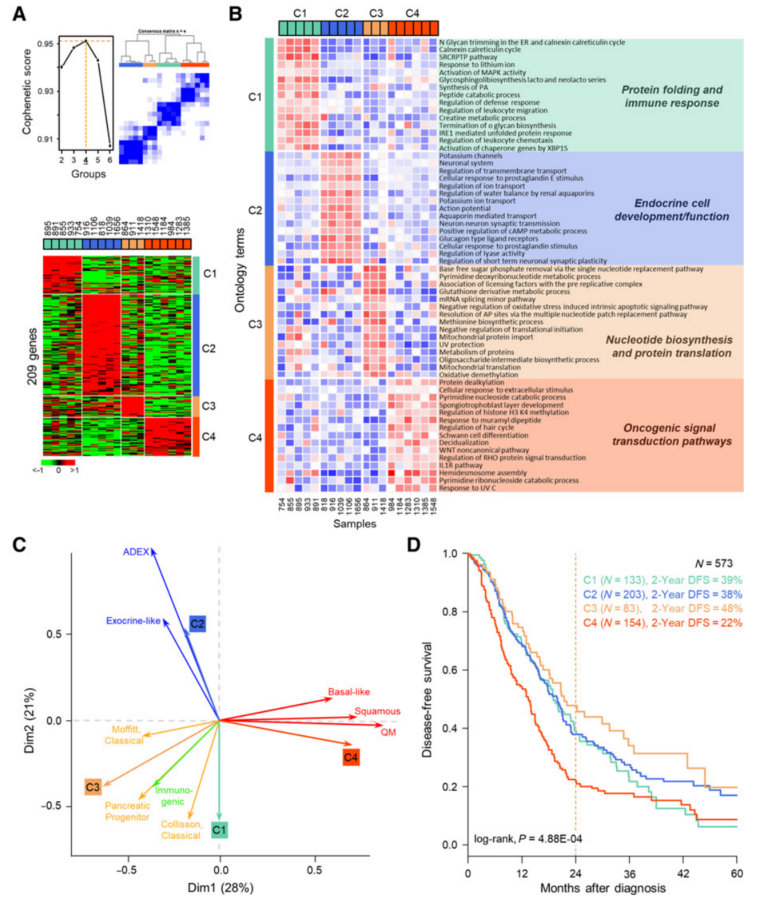
图2 通过RNA-seq鉴定的PDAC细胞的转录亚型
对相邻间质的基因表达数据进行类似的聚类分析,分为三种间质亚型(S1-S3),(图3A)中一种是由单个样本定义的(图3A,TOP),因此进一步的分析是基于聚类产生由274个基因指定的。与癌症亚型分析一样,GSVA是对相邻间质的亚型进行的,S1亚型与发育和细胞分化有关,S2亚型与抗原处理和提呈有关,S3亚型与磷脂合成和大分子修饰有关(图3B)。
癌症相关成纤维细胞(CAF)是肿瘤间质的主要细胞类型,最近的研究定义了这些细胞在转录上独特的亚群。对Elyada报告的基因表达特征的研究发现,抗原提呈的CAF与S3亚型之间存在显著相关性。LCM间质亚型与Moffitt及其同事定义的LCM间质亚型的比较显示,正常和激活的间质亚型分别在我们的S1和S2亚型中富集(图3C)。本研究的间质亚型与Neuzillet描述的四种CAF亚型之间没有相关性。本研究发现的间质特异性亚型也与DFS相关,S1与较好的预后相关(图3D)。
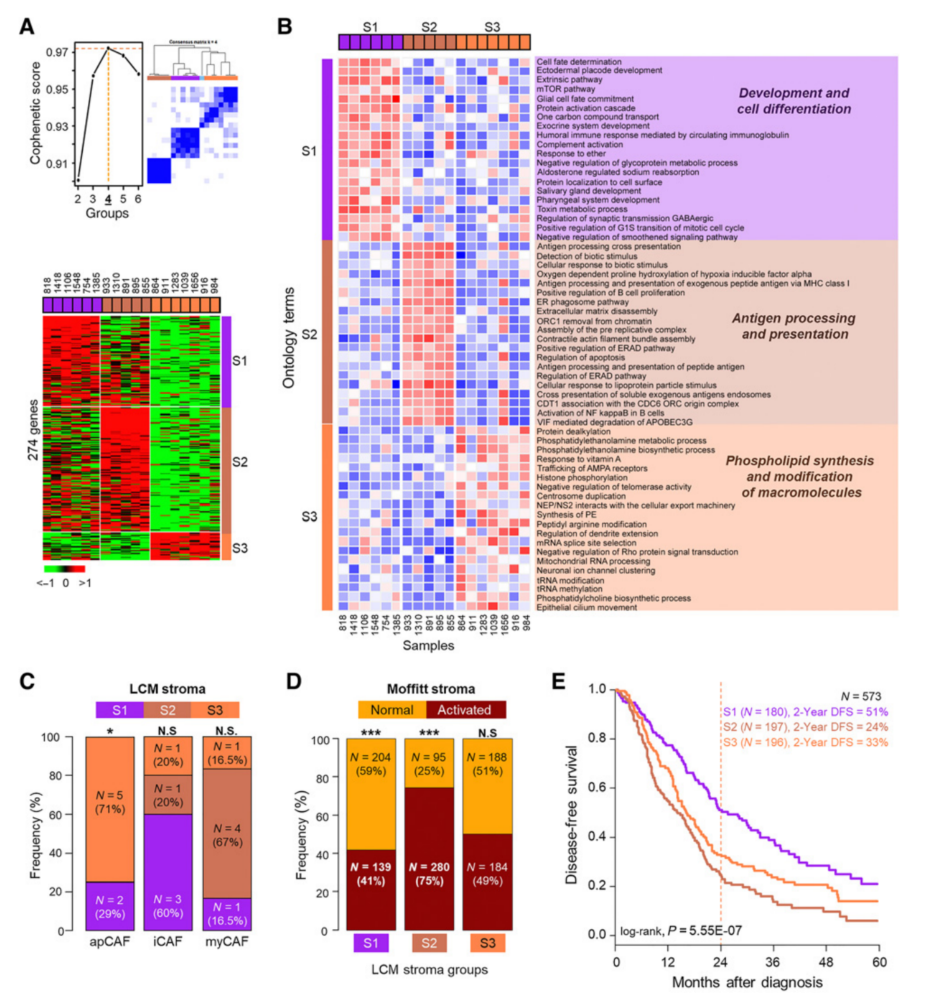
图3 通过RNA-seq鉴定的基质细胞的转录亚型
2、鉴定与存活率相关而与亚型无关的基因表达特征
为寻找与癌症和间质DFS相关的预后基因表达特征,选择了一组13个样本,12个月短期存活者(STS,5)和24个月长期存活者(LTS,8)。两组的临床病理参数和分子亚型差异无统计学意义。在癌症区域,对RNA-seq数据分析发现了STS组和LTS组之间差异表达的111个基因(图4A)。为了更好地了解STS和LTS组之间基因程序的差异,对相关的GO生物学过程进行了分析(图4B)。STS组中强激活通路的通路与细胞可塑性(COMP、MUC16、PLXNC1、FGF1、IRS1、SEMA6C、HOXB5)、轴突引导(AP2A1、FGF1、GLI2、IRS1、PLXNC1、SEMA6C)、细胞增殖(FGF1、IRS1、MZB1、FGF1、HSPA1A、TLR2、ALOX15B、PTGES)和信号转导(ARHGAP23、ARHGAP42、AP2A1、CRABP2、FGF1、IRS1、KRT17、PDE10A、PTGES、SPOCK2、TLR2、ZNF217、EPLKHHG2、WIPF1)有关。相反,LTS患者强激活通路的通路富集于与细胞周期调节相关的通路(CDK4、CDKN2C、KNTC1、NUP88、TP53INP1)以及tRNA和mRNA加工(RBM23、SCAF8、NUP88、TRMT11、TRMT5)。
在单因素分析中,只有美国癌症联合委员会(AJCC)临床分期这一个临床病理变量与DFS(Wald检验)相关。本研究的111个癌症基因预后分类也与DFS相关。在多因素分析中,仅有111个基因分类和AJCC临床分期仍有显著意义,证实了独立的预后价值。在间质隔室,一种类似的方法确定了109个基因在LCM捕获的样本的STS和LTS之间差异表达。在573名患者的独立验证集中,对包含111个癌症基因的预后分类的稳健性进行了检验。该分类将患者分为两个亚组,STS组(n=323;56%)和LTS组(n=250;44%),2年DFS分别为30%和42%(图4C)。
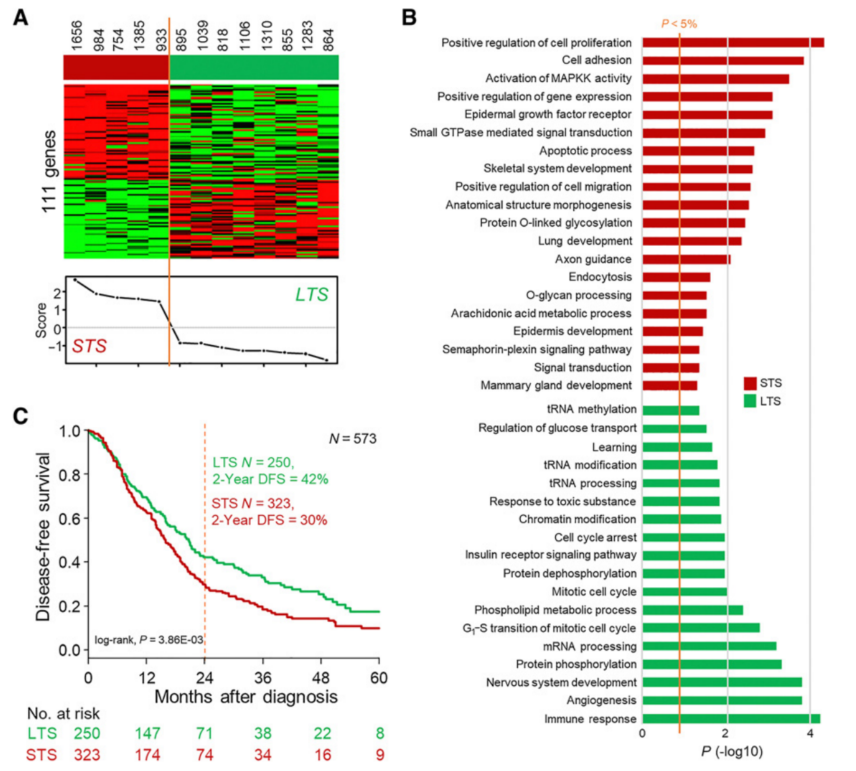
图4 在PDAC细胞中,与存活相关的基因表达特征的鉴定
3、13个基因预后表达特征的鉴定和验证
为了在独立的PDAC样本队列中验证本研究的基因分类器,从111个基因列表中构建了一个多基因分类器。在111个基因中,有13个基因在癌细胞异表达(图5A),包括8个上调的基因(MIA、MUC16、LYNX1、PSCA、ADGRF1、KLK6、KRT17和MFSD9)和5个下调的基因(AP5M1、TCP1、PNP、ANKRD39和CDK4)。在573名患者的独立验证集中测试了这个由13个基因组成的预后分类器。与111基因分类器类似,13基因分类器将573例患者分为两个亚组:STS(n=314;55%)和LTS(n=259;45%),2年DFS分别为29%和43%(图5B),从而证实了其预后价值。
进一步研究基于13个基因特征的分类与样本的临床病理变量之间的相关性;未发现与患者的年龄和性别、AJCC分期、病理类型、肿瘤大小和淋巴结状况相关。接下来,将13基因分类器的预后价值与验证集中其他临床病理变量的预后价值进行了比较。在单因素分析中,只有AJCC临床分期和本研究的13基因肿瘤分类与DFS(Wald检验)相关。在多因素分析中,仅有AJCC临床分期和AJCC分类仍有显著意义,提示有独立的预后价值。
为了进一步检验这些基因在预测患者肿瘤临床行为方面的有效性,开发了一种双色RNA-ISH方法,其中包括与LTS(蓝色)相关的三个基因(AP5M1、TCP1和PNP)以及与STS(红色)相关的三个基因(MIA、MUC16和ADGRF1)。这一分析被用来探测由手术切除的PDAC肿瘤样本组成的TMA(图5C)。总共对111个肿瘤核心进行盲法评分,通过视觉组织学确认来确定这些基因在癌细胞中的特异性表达。与LCM分析一致,在这些肿瘤样本的间质中观察到这些基因的有限表达。这些分析确定了51个与LTS相关的肿瘤,以及60个与STS相关的肿瘤。用STS探针染色的肿瘤患者的OS比用LTS探针染色的患者的OS更短(图5D)。经多因素分析,只有切除边缘状态和RNA-ISH评分与OS显著相关(图5E)。

图5 基因RNA-ISH检测是一个独立的生存预后因素
三、研究结论
通过LCM和RNA-seq技术鉴定出四种癌细胞亚型(C1-C4)和三种癌旁间质亚型(S1-S3),这些间质特异性亚型与DFS相关。选取13个基因进行预后分类,并通过573名患者的独立验证集和开发的RNA-ISH方法验证了其预后评估价值。
参考文献:
Transcriptomic Analysis of Laser Capture Microdissected Tumors Reveals Cancer- and Stromal-Specific Molecular Subtypes of Pancreatic Ductal Adenocarcinoma.[J]CLINICAL CANCER RESEARCH, 2021.