| 时间:2024-02-23 |
2022年发表于《PNAS》(IF =11.1)
一、研究背景
“先锋”转录因子(TFs)在构建细胞类型特异性基因表达谱中起着重要作用,其可以结合封闭的染色质,使其他DNA结合蛋白得以结合。细胞类型特异性先驱TF早期B细胞因子1 (EBF1)在B谱系构建中起关键决定作用。B谱系特异性基因表达的激活也需要BRG1的功能,它通过与EBF1的c端结构域相互作用被招募到EBF1结合位点。为研究EBF1的功能与局部染色质的可及性的关系,采用降解TAG (dTAG)系统诱导降解EBF1,EBF1降解导致EBF1全基因组结合和EBF1靶向BRG1结合缺失。染色质可及性在EBF1结合位点迅速降低,染色质可及性降低与基因表达改变相关。因此,祖B细胞的转录和表观遗传状态的稳定维持需要EBF1的持续活性。
二、研究结果
1、dTAG诱导的EBF1降解
为了dTAG诱导的EBF1蛋白快速降解,将FKBP12F36V降解标签融合到EBF1的氨基(N)或羧基(C)端,并构建载体(图1A)。生成祖B细胞,其中内源性EBF1蛋白已被FKBP12F36V标记的EBF1蛋白取代,称为EBF1- FKBP (N)和EBF1- FKBP (C);并删除内源性Ebf1等位基因。在添加dTAG13后2小时、4小时和24小时,通过免疫印迹分析评估蛋白水平,发现N端和C端标记的EBF1蛋白水平在2小时后已经显著降低(图1C)。ChIP-seq结果显示,在6 h时的EBF1在CTD非依赖性和CTD依赖性位点的结合减少(图1D)。图1E和1F分析显示,绝大多数EBF1结合位点的EBF1占用率显著降低。对于不依赖于CTD的基因(Igll1和Cd19)和依赖于CTD的基因(Asb2和Cd72),证实了EBF1的结合减少(图1G)。综上所述,dTAG诱导的EBF1降解,使得EBF1在CTD依赖位点和CTD不依赖位点上染色质结合减少。
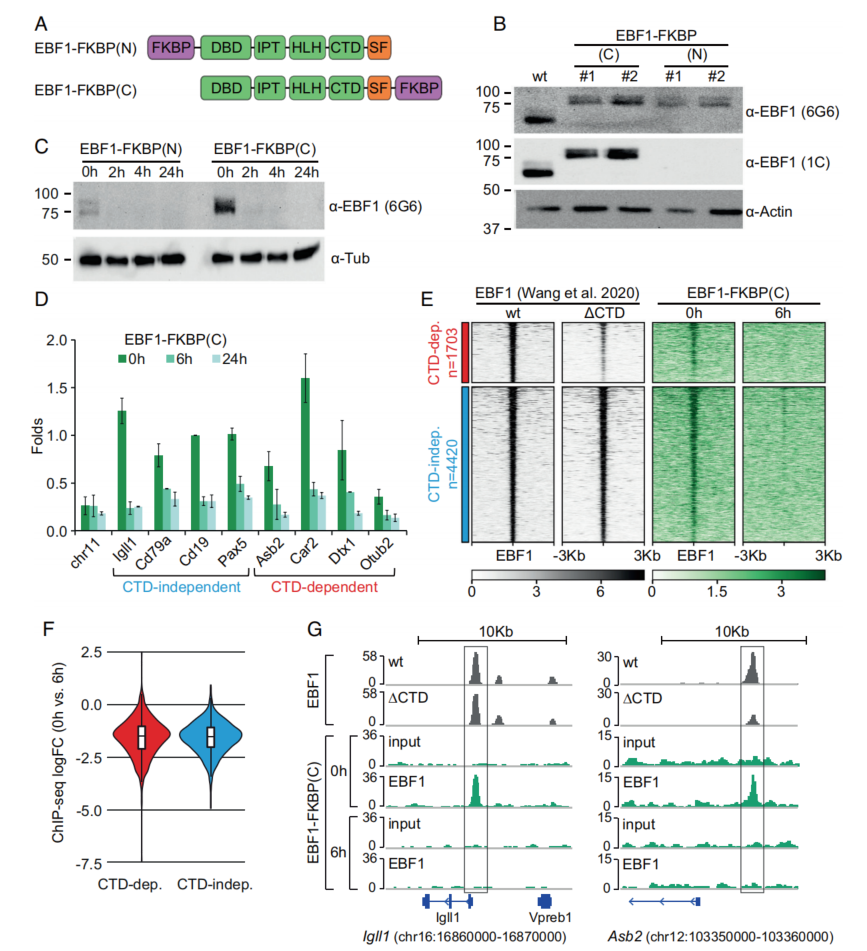
图1 dTAG13诱导EBF1的降解
2、EBF1的缺失导致BRG1结合减少和染色质可及性降低
之前的研究已经证明EBF1能够招募BRG1,从而促进naïve祖染色质的局部开放。为了研究诱导EBF1降解对EBF1结合位点BRG1结合的影响,对表达EBF1-FKBP(N)的祖B细胞进行了ChIP检测。在6h检测到CTD依赖位点和CTD不依赖位点的BRG1结合减少,在24h没有进一步的变化(图2A)。6h后DNase I超敏反应减少(图2B)。对未经处理和dTAG13处理的表达EBF1-FKBP(N)的细胞进行了BRG1 ChIP-seq和ATAC-seq。与未处理的情况相比,dTAG13处理6 h时BRG1的峰值减少,即CTD依赖性位点的BRG1结合减少比CTD非依赖性位点更为明显,绝大多数缺乏EBF1占用区域在没有发生变化(图2C、2D、2E、2F)。在单个基因上,还观察到EBF1降解对BRG1募集和局部染色质可达性的不同影响(Car2,Cd19)(图2G和2H)。
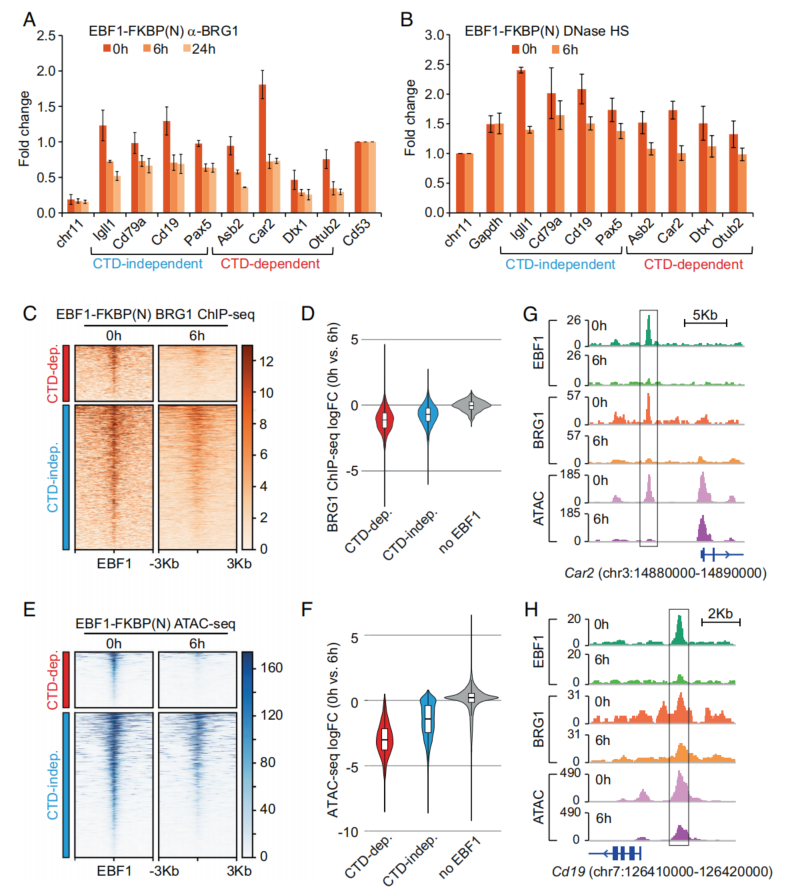
图2 EBF1的缺失导致BRG1结合减少和染色质可及性降低
CTD非依赖性位点可及性的变化可能与结合在CTD非依赖性EBF1结合位点附近的TF的代偿功能有关(19)。因此,查询了祖B细胞公开可用的TF结合数据,并检测到PU.1、Ikaros和FOXO1在CTD非依赖性位点的优先结合,而E2A和PAX5在CTD依赖性位点和CTD非依赖性位点的结合相似(图3A)。作为ATAC峰对EBF1缺失差异敏感性的一个例子,Ccr7基因中有一个与EBF1相关的ATAC峰同时被PU.1和PAX5结合的位点被保留,而相邻的没有PU.1和PAX5占用的ATAC峰明显减少(图3B)。尽管ATAC峰的减少程度与EBF1基序的数量相关,但CTD依赖位点的ATAC峰相对于CTD非依赖位点的优先减少与EBF1基序的数量无关(图3C)。因此,邻近TF在不依赖CTD位点的结合,可能会减少EBF1降解时造成的染色质可及性的降低。
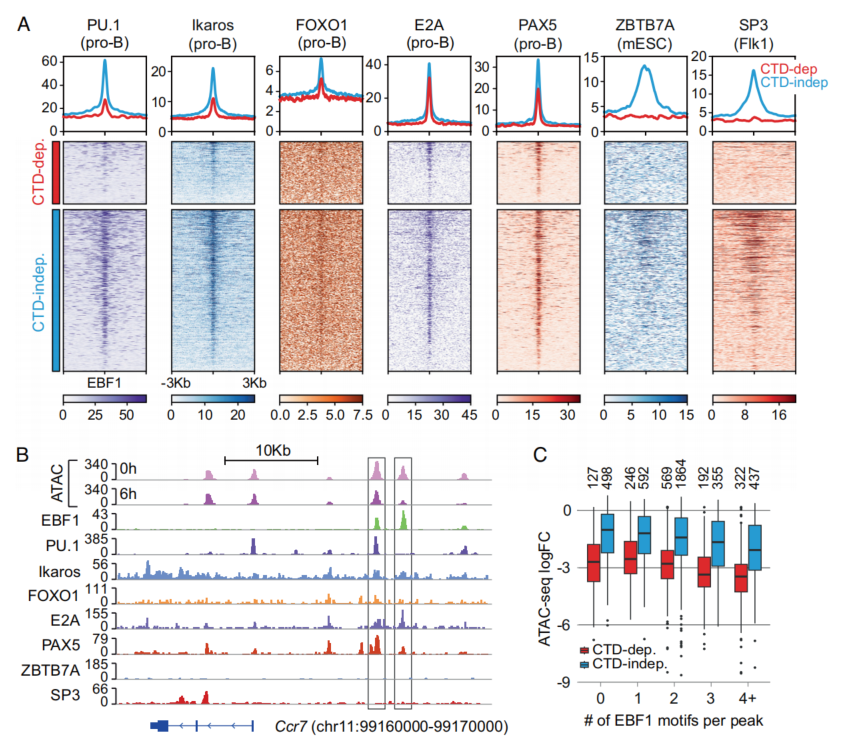
图3 EBF1与其他TF共同占用不依赖CTD的位点
3、EBF1缺失后靶基因表达的快速变化
dTAG诱导的TF的快速降解可用于鉴定直接靶基因。为了鉴定EBF1的直接靶基因,使用链特异性并且去除核糖体RNA的总RNA-seq。图4A显示了相关调控基因的外显子和内含子表达变化。最后,利用ATACseq和EBF1 ChIP-seq数据对RNA-seq数据进行分析,以确定EBF1的直接靶点,并更好地了解这些基因对EBF1降解的差异调控。在EBF1降解后,299个基因ATAC峰降低;在该基因集中,158个基因下调(被EBF1激活),141个基因上调(被EBF1抑制)(图4B)。此外,在未经处理的祖B细胞中,80%至90%的这些基因与EBF1结合,鉴定出这些基因是EBF1的直接靶点。
观察到EBF1结合位点的染色质可及性降低,以及EBF1降解后相关基因(例如Vsir和Ccr7基因)的RNA表达增加,主要因为染色质可及性降低发生在启动子远端位点,而TSS附近的ATAC峰普遍增加,与RNA表达增强一致。为了探究EBF1介导的靶基因激活与EBF1抑制之间的差异,比较了EBF1缺失时下调或上调的基因启动子上的TF结合基序。ATAC峰降低的上调基因的启动子区域显示MEF2C、DLX和STAT1:STAT2的结合基序显著富集,而下调基因的启动子区域未观察到特异性TF结合基序的显著富集(图4E)。
GO分析显示,EBF1消除后ATAC峰下调的基因,与细胞粘附、淋巴细胞增殖和小GTPase信号相关的基因富集(图4F)。有趣的是,ATAC峰降低的上调基因富集于T细胞和NK细胞分化(图4G)。使用GSEA比较了dTAG13处理后EBF1占据基因的数据与先前发表的EBF1靶基因集,发现在EBF1降解6小时下调的基因与EBF1诱导24小时上调的基因之间存在很强的相关性(图4h)。
综上所述,dTAG13诱导EBF1降解后的局部染色质关闭导致EBF1靶基因的快速下调和上调。
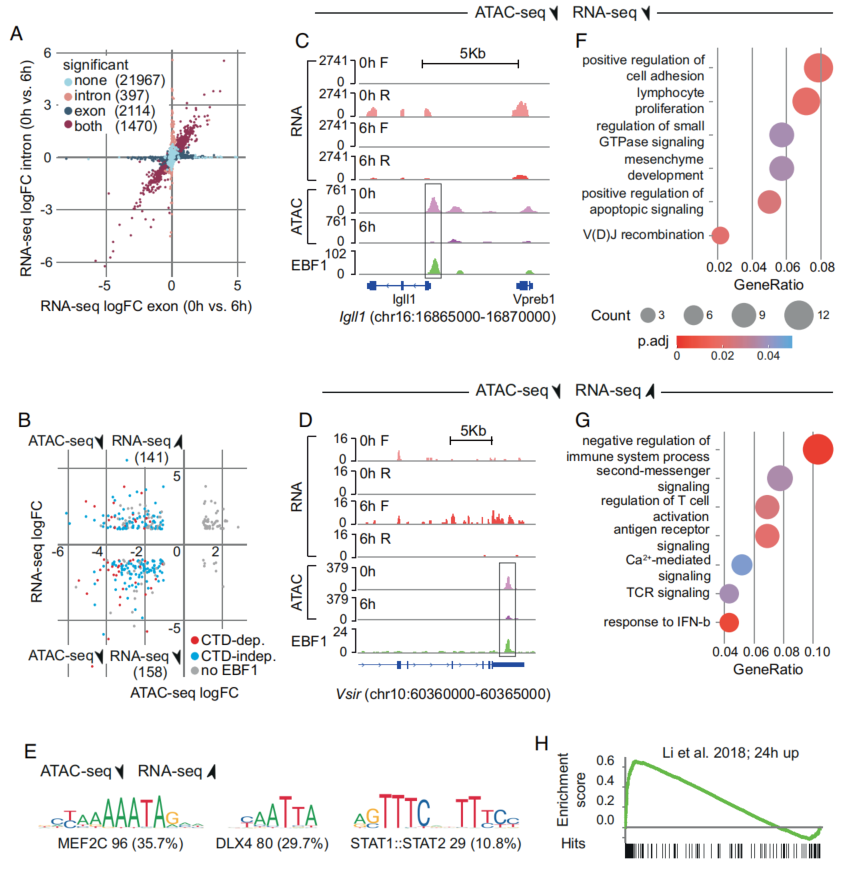
图4 EBF1的缺失导致EBF1靶基因表达的快速失调
三、研究结论
祖B细胞(EBF1- FKBPf36v)中添加dTAG13二聚体可快速降解EBF1,导致EBF1结合和EBF1靶向BRG1结合减少。EBF1结合位点的染色质可及性迅速降低,相关基因的表达也发生了变化。因此可知,EBF1对于维持祖B细胞表观遗传状态的稳定和基因的转录有重要作用。
参考文献:
EBF1 is continuously required for stabilizing local chromatin accessibility in pro-B cells.[J]PNAS, 2022.