| 时间:2024-02-04 |
2022年发表于《Clinical And Translational Medicine》(IF =10.6)
一、研究背景
N6 -甲基腺苷(m6A)是真核生物mRNA中常见的一种甲基化修饰,参与多种肿瘤的发生发展,影响RNA的剪接、衰变、输出和翻译。在黑色素瘤中的报道主要集中在m6A的甲基化酶和去甲基化酶,而 m6A识别蛋白如YTHDF3在黑色素瘤中的具体作用尚不清楚。黑色素瘤是最恶性的皮肤肿瘤,现有药物存在耐药和低疗效的问题,需要寻找新的治疗靶点和药物。
在本研究中,发现与良性痣样本或表皮黑色素细胞相比,YTHDF3在黑色素瘤组织和细胞系中高表达;体外和体内食盐均证实YTHDF3对黑色素瘤的转移有影响。通过多组学分析确定了LOXL3是YTHDF3在黑色素瘤中的最佳靶点。YTHDF3可以增加LOXL3的蛋白表达,但不影响其mRNA水平,并且依赖于m6a。本研究揭示了YTHDF3及其靶点LOXL3在黑色素瘤转移中的致癌作用及其特定的作用方式。
二、研究结果
1、YTHDF3在黑色素瘤组织和细胞系中高度表达
数据集GEPIA、GEO、和UALCAN 的结果显示YTHDF3在黑色素瘤组织中高表达(图1A、B)。GEPIA和UALCAN数据库以TCGA数据库为基础。与原发性黑色素瘤相比,YTHDF3在转移性黑色素瘤中的表达更高(图1C、D)。在这些数据集中,还发现了多个m6A识别蛋白如YTHDF1、YTHDF2、YTHDC1和YTHDC2的表达模式,但只有YTHDF3在所有数据集中都有一致的显著表达,表明YTHDF3可能在黑色素瘤的转移中起着至关重要的作用。
采用RT-qPCR和Western blo比较了YTHDF3在不同组织中的RNA和蛋白表达水平(图1E-G)。免疫组化结果显示,与良性痣组织相比,YTHDF3在黑色素瘤组织样本中表达较高(图1H)。这些发现表明,YTHDF3在黑色素瘤组织和细胞系中高度表达,并可能对黑色素瘤转移等产生影响。
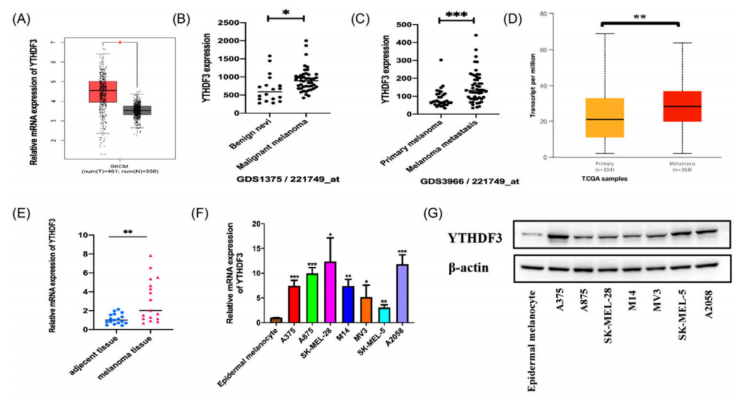
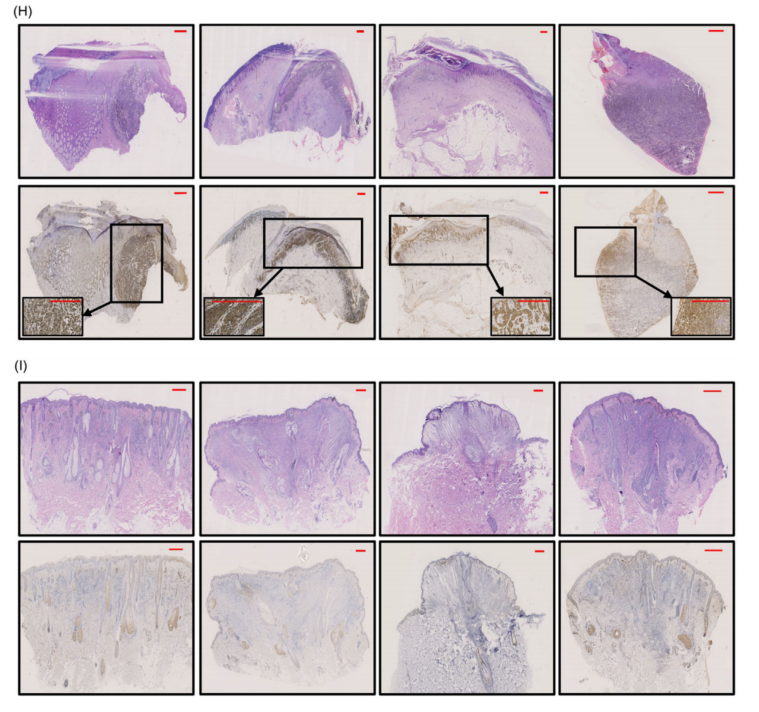
图1 YTHDF3 在黑色素瘤中的表达增加
2、YTHDF3在体外调控黑色素瘤细胞的迁移和侵袭
为了确定YTHDF3对黑色素瘤的迁移和侵袭等的影响,在体外进行了相关实验。通过shRNA(shYTHDF3-1和shYTHDF3-2)下调了黑色素瘤细胞(包括A375、SK-MEL-28和A2058细胞)中的YTHDF3表达。通过RT-qPCR和蛋白质印迹法测定其下调效率(图2A);通过transwell(图2B-D)和伤口愈合实验(图2E-G)检测YTHDF3下调对黑色素瘤细胞迁移和侵袭的抑制作用。这些结果表明,YTHDF3可能是调控黑色素瘤细胞迁移和侵袭的重要分子,这一现象与YTHDF3在转移性黑色素瘤组织中的表达增强一致。
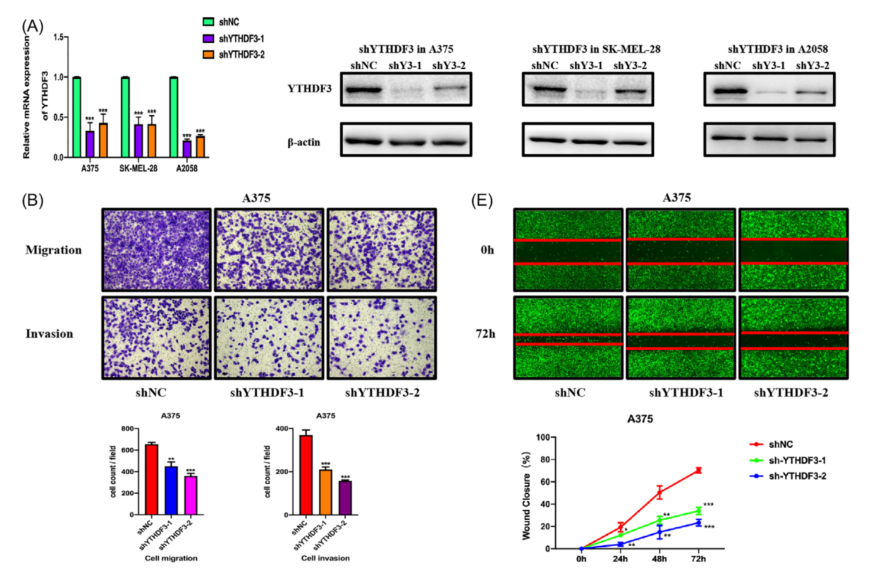
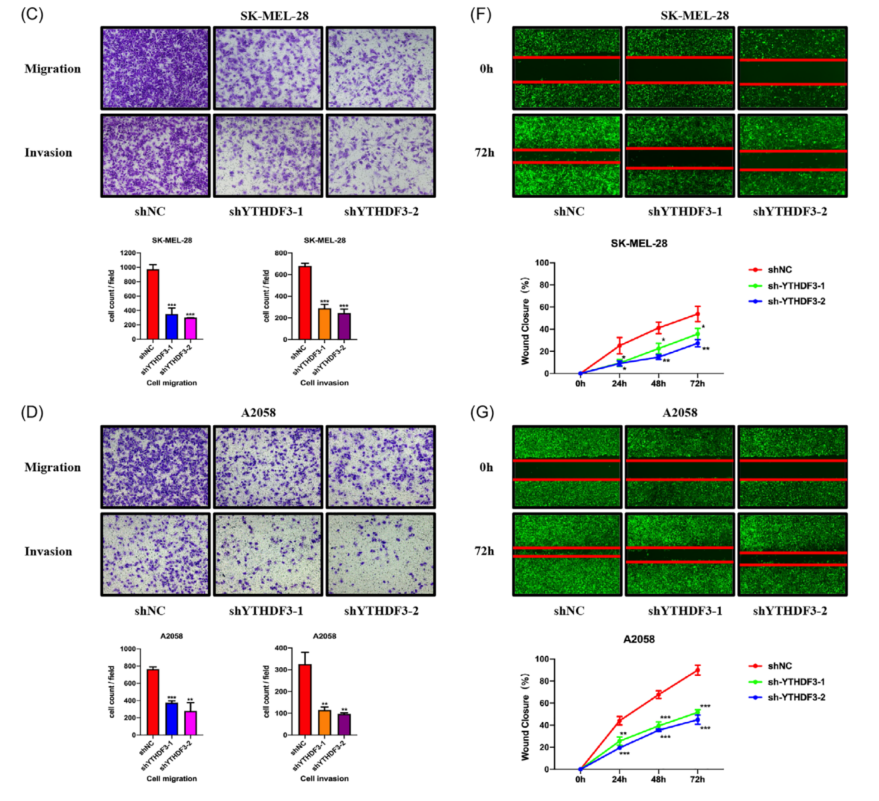
图2 YTHDF3下调在体外抑制黑色素瘤细胞迁移、侵袭和转移
3、YTHDF3在体内调控黑色素瘤的转移
为评价YTHDF3在体内的作用,建立了YTHDF3下调(shYTHDF3-1)表达荧光素酶的A375细胞和相应的对照shNC细胞,并对裸鼠进行尾静脉注射肿瘤转移模型。应用活体成像系统评估肿瘤在全身和关键器官的转移情况。7周后,观察到注射YTHDF3-下调细胞的小鼠转移率较低。与shNC组相比,shYTHDF3组的转移性皮下肿瘤和肺转移较少(图3A-D)。这些结果表明,敲低YTHDF3可以抑制黑色素瘤在体内的转移。
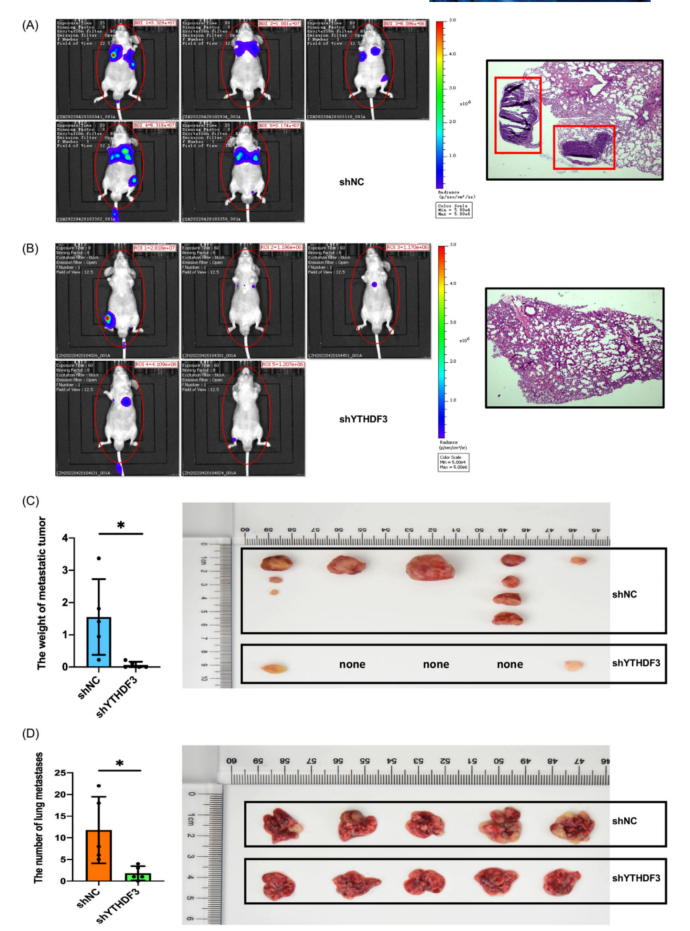
图3 YTHDF3下调抑制黑色素瘤体内转移
4、通过多组学分析确定了YTHDF3的下游靶点
为了找出YTHDF3调控的靶点,进行了RNAseq、MeRIP-seq、RIP-seq和质谱分析。RNA-seq结果,YTHDF3下调后,133个基因下调,249个基因上调(p < 0.05,且|log2FoldChange|≥1)(图4A)。KEGG分析结果显示,与肿瘤恶性行为、细胞外基质、细胞迁移调控和细胞粘附相关的基因富集(图4B、C)。GSEA分析显示,YTHDH3下调后的差异表达基因与血管生成和上皮间质转化相关(图4D、E)。
为了找到富含m6A位点并与YTHDF3结合的靶标,进行了MeRIP-seq和RIP-seq。并对A375细胞的shNC和shYTHDF3进行MeRIP-seq,获得了26618个m6A峰,并且在两组中都鉴定出了m6A的motif GGAC(图4F、G),显示了m6A修饰的富集。根据MeRIP-seq的KEGG分析,富集的基因集中在局灶黏附、ECM受体相互作用、RNA剪接和mRNA加工中,与癌症相关的通路基因也被富集(图4H、I)。此外,这些m6A修饰主要富集在CDS和3'UTR区域(图4J-L)。RIP-seq在空白A375细胞中的结果显示,420个转录本可能是YTHDF3的潜在靶点。GO分析也显示富集于局灶性黏附和粘附体连接等(图5A)。
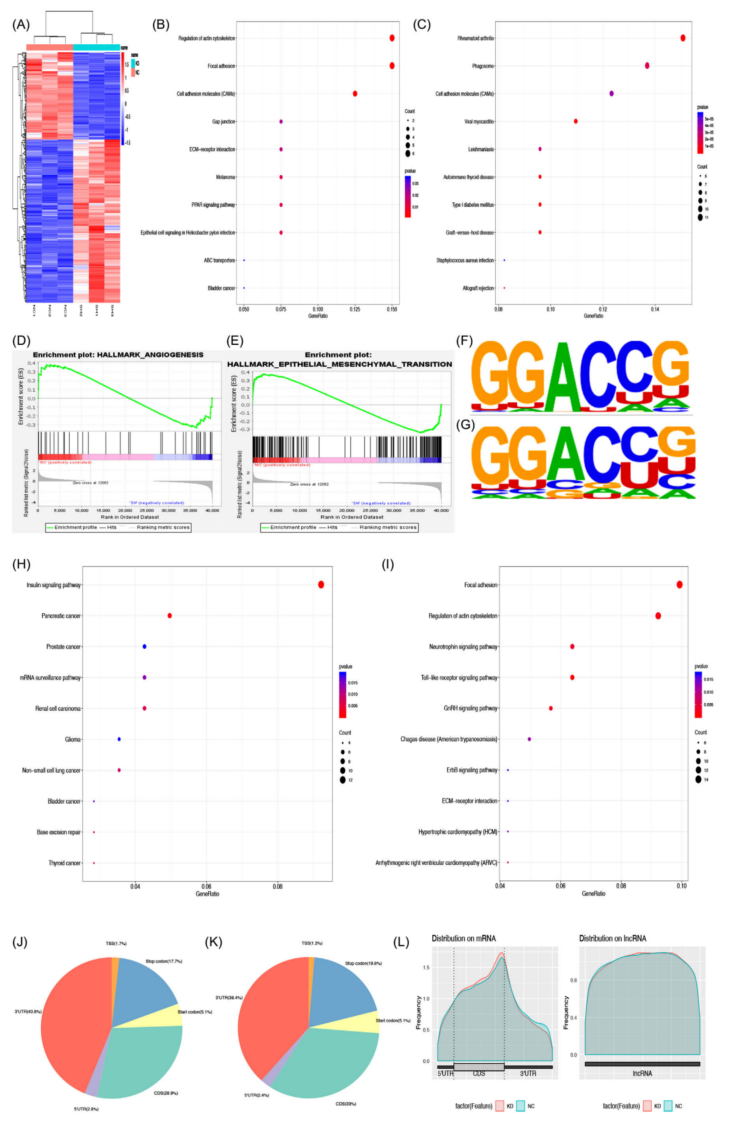
图4 黑色素瘤细胞中 YTHDF3 调控的转录谱
先前的报道表明,YTHDF3可以在不影响其mRNA水平的情况下调节其靶标的翻译效率。因此,进一步研究黑色素瘤中是否存在类似的情况。为了更特异地寻找蛋白水平降低的靶点,对A375细胞的shNC和shYTHDF3进行了质谱分析。GO分析(图5B、C)和KEGG分析(图5D、E)表明,与ECM和细胞连接相关的差异表达蛋白富集。 根据MeRIP-seq和RIP-seq,重点研究了富含m6A位点并与YTHDF3结合的转录本。在重叠部分中,剔除了RNA-seq之间差异表达的转录本。此外,还包括了减少的蛋白质。经过筛选,选择了多个靶点LOXL3、CHD7和PDE3A(图5F、G)。
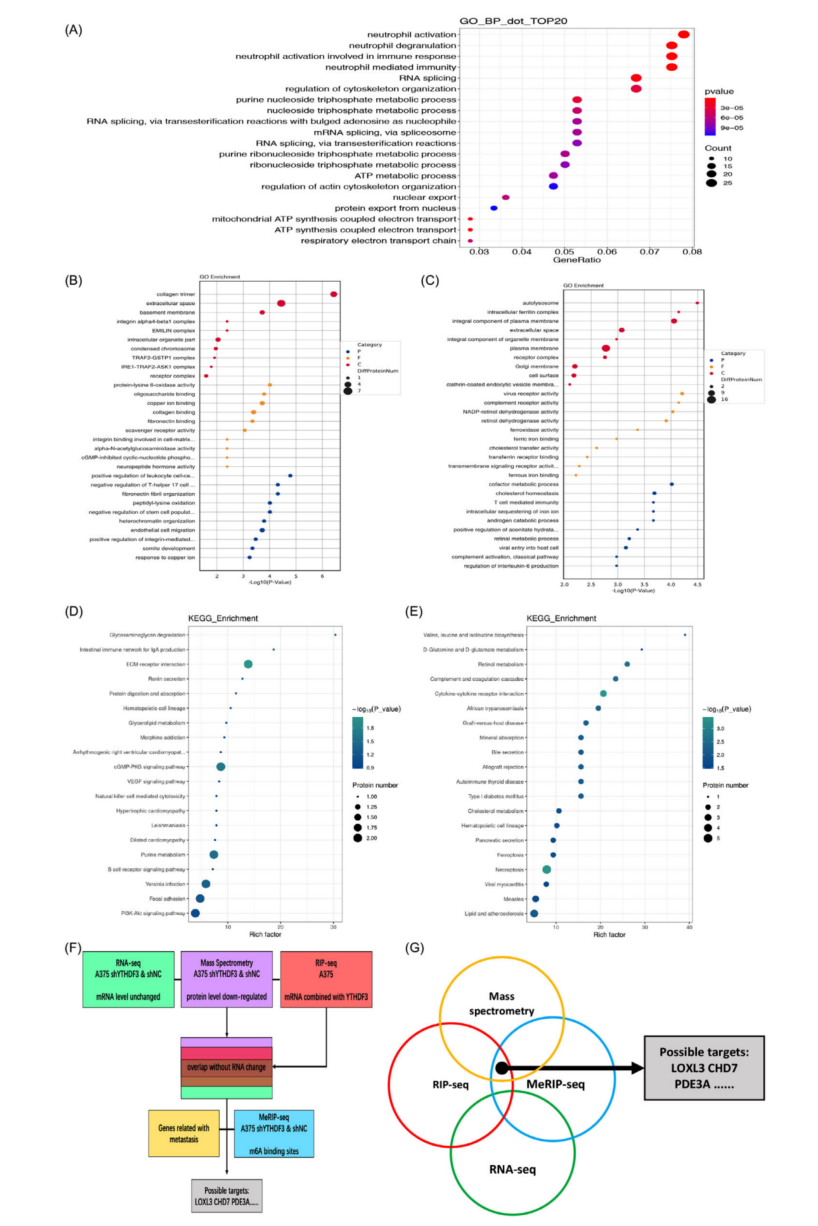
图5 黑色素瘤细胞中 YTHDF3 靶向的潜在分子
5、YTHDF3调控LOXL3的翻译依赖于m6A
之前的研究文献显示,LOXL3、CHD7和PDE3A可以调节恶性肿瘤行为。利用RIP-qPCR,我们进一步证实,在SK-MEL-28黑色素瘤细胞中,YTHDF3可以捕获除PDE3A外的这些转录本(图6A、B)。接下来,评估了与细胞外基质相关的LOXL3的表达。在A375、SK-MEL-28和A2058三个黑色素瘤细胞系中证实了,下调YTHDF3 (shYTHDF3-1和shYTHDF3-2)的mRNA和蛋白水平后,LOXL3的蛋白水平显著降低,而mRNA水平几乎不变(图6C、D)。通过对GEPIA数据集的Pearson相关分析,发现LOXL3的mRNA水平与YTHDF3的mRNA水平不相关(图6E)。
此外,还检测了CHD7和PDE3A的mRNA和蛋白水平, CHD7的表达模式与LOXL3相似。PDE3A差异可能是由其转录本上的m6A位点引起的。对这三个转录本的IGV结果也进行了分析。由此推测YTHDF3可能会影响LOXL3的翻译过程,而这一过程可能与m6A位点有关。然后,研究了三种黑色素瘤细胞系中常见的甲基转移酶和去甲基化酶如METTL3、METTL14、FTO和ALKBH5的表达,这表明在黑色素瘤细胞系中存在m6A修饰过程。敲低YTHDF3表达后全局m6A水平没有变化(图6F),这与之前的报道一致。更重要的是,MeRIP-qPCR结果显示,在三种黑色素瘤细胞系中,shNC组和shYTHDF3组之间LOXL3的m6A水平没有显著变化(图6G、H)。这些结果与上述MeRIP-seq一致。
为了验证YTHDF3对LOXL3调控环依赖于LOXL3的m6A位点,应用CRISPR/Cas13工程技术,获得了一个由催化死亡的VI-B型Cas13酶(dCas13)和m6A去甲基化酶FTO组合的融合蛋白(图6I)。 sgRNA是专门针对LOXL3的m6A位点设计的。 在A375、SK-MEL-28和A2058细胞中共转染dCas13bFTO融合蛋白和gRNA (sgNC和sgLOXL3)。然后,研究了dCas13b-FTO-sgNC组和dCas13b-FTO-sgLOXL3组之间的m6A水平。与dCas13b-FTO- sgNC组相比,转染dCas13b-FTO和sgLOXL3后,LOXL3上m6A水平明显降低(图6J)。进一步通过RIP-qPCR验证了YTHDF3和LOXL3之间的连接是否被破坏。正如预期的那样,在dCas13b-FTO-sgLOXL3组中,YTHDF3对LOXL3 mRNA的富集程度不如dCas13b-FTO-sgNC组,而dCas13b-FTO-sgNC组仍然可以富集LOXL3 mRNA(图6K、L)。这些结果验证了dCas13b-FTO-sgLOXL3工具可以导致LOXL3 mRNA的去甲基化,YTHDF3蛋白与LOXL3 mRNA的相互作用是通过LOXL3上的m6A位点实现的。此外,为了了解YTHDF3如何影响其靶点LOXL3的蛋白水平,通过eIF3A-RIP-qPCR检测eIF3A是否为促进翻译的潜在原因。下调YTHDF3后,eIF3a对LOXL3转录本的结合能力明显降低(图6M,N)。这一结果可以作为YTHDF3影响LOXL3翻译的证据。
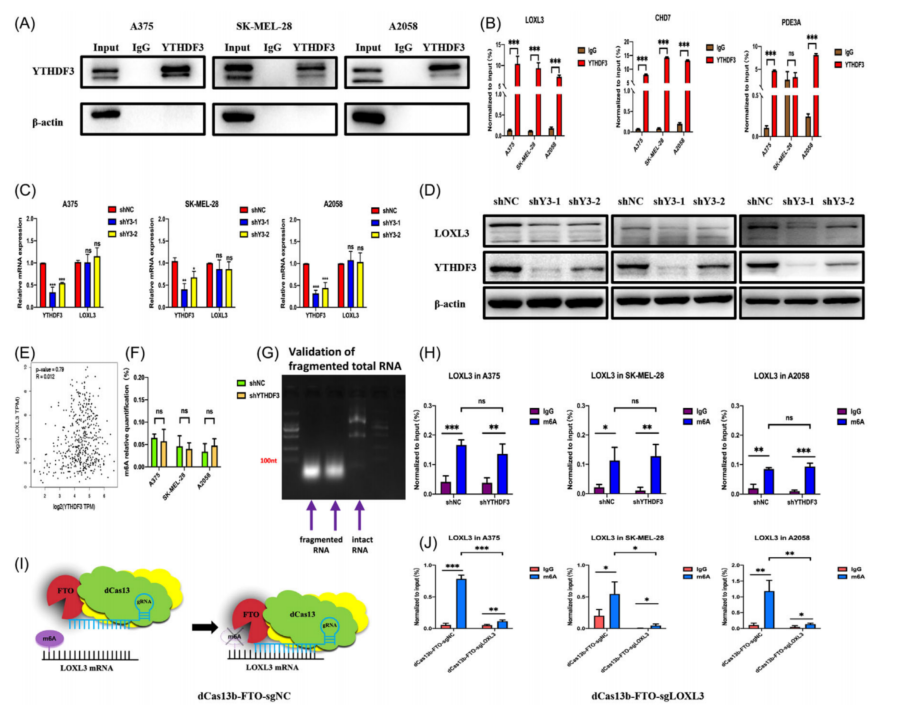
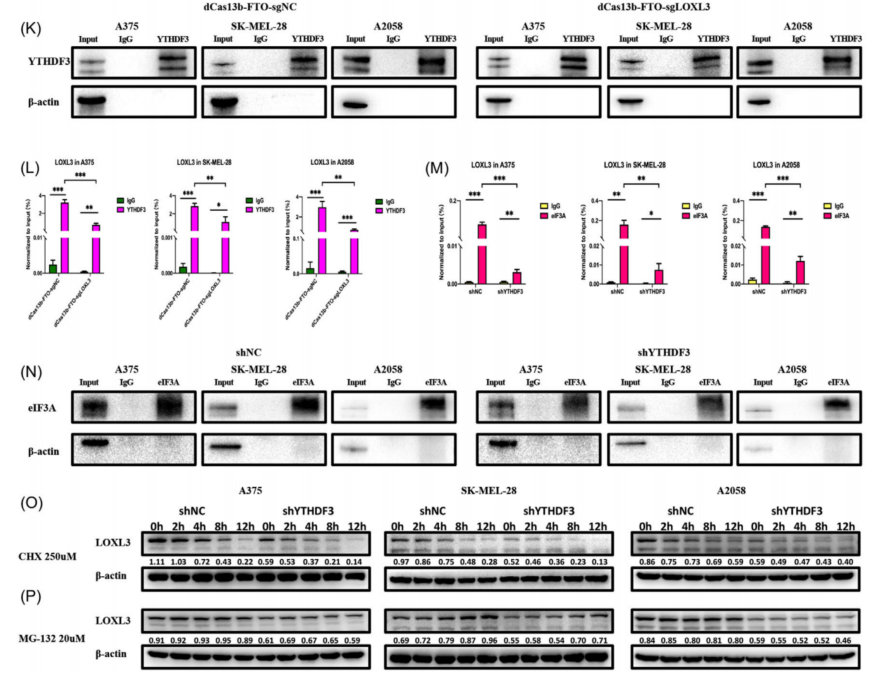
图6 YTHDF3对LOXL3的调控依赖于m6A
6、LOXL3调控黑色素瘤的迁移和侵袭
以上结果提示YTHDF3的致癌作用依赖于LOXL3,因为LOXL3的致癌功能在黑色素瘤中已经有报道。因此,进一步确定LOXL3在黑色素瘤细胞中的表达和致癌作用。GEPIA和UALCAN数据库显示,LOXL3在黑色素瘤,尤其是转移性黑色素瘤中过表达(图7A、B)。本研究验证了mRNA和蛋白在黑色素瘤组织(图7C)和黑色素瘤细胞系A375、A875、SK-MEL-28、M14、MV3、SK-MEL-5和A2058中的表达水平(图7D、E)。与YTHDF3的表达类似,与表皮黑色素细胞相比,黑色素瘤细胞中LOXL3的mRNA和蛋白水平升高。利用慢病毒构建了LOXL3下调和过表达的A375、SK-MEL-28和A2058黑色素瘤细胞(shLOXL3-1、shLOXL3-2和OE LOXL3)。通过RT-qPCR和Western blot检测下调效率(图7F和8A)。通过transwell实验(图7G-I)和伤口愈合实验(图7J-L)观察到,LOXL3下调对黑色素瘤细胞的迁移和侵袭有显著的抑制作用,而过表达LOXL3可以促进transwell实验(图8B、C)和伤口愈合实验(图8D、E)观察到的黑色素瘤细胞的迁移和侵袭。这些结果表明,LOXL3促进了黑色素瘤细胞的迁移和侵袭,YTHDF3的功能可能依赖于LOXL3。
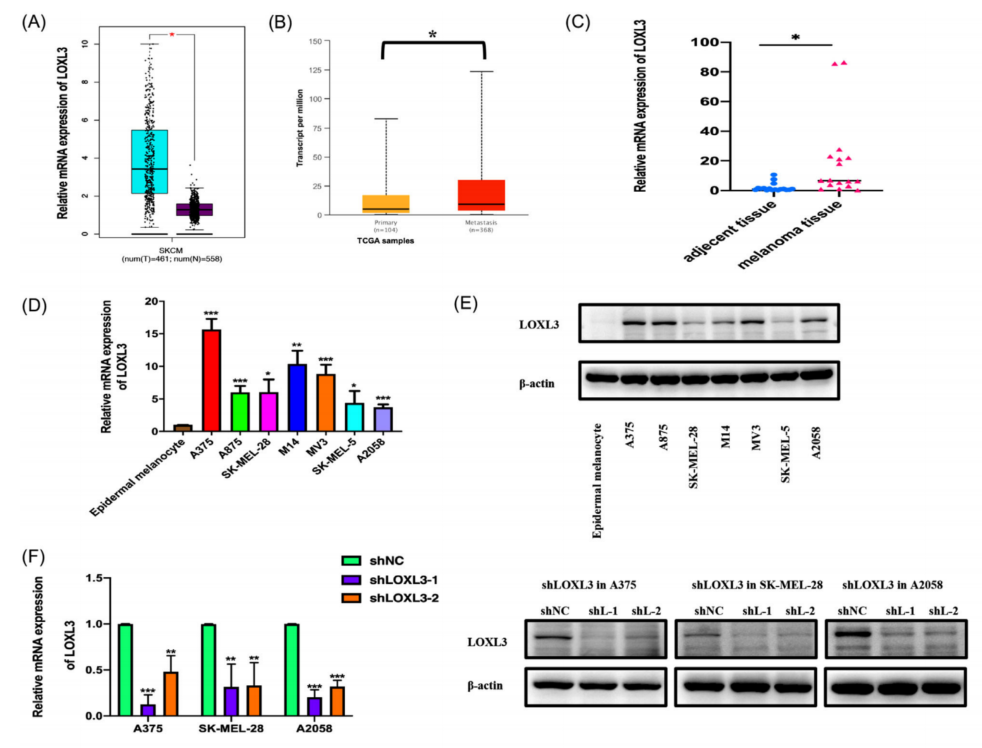
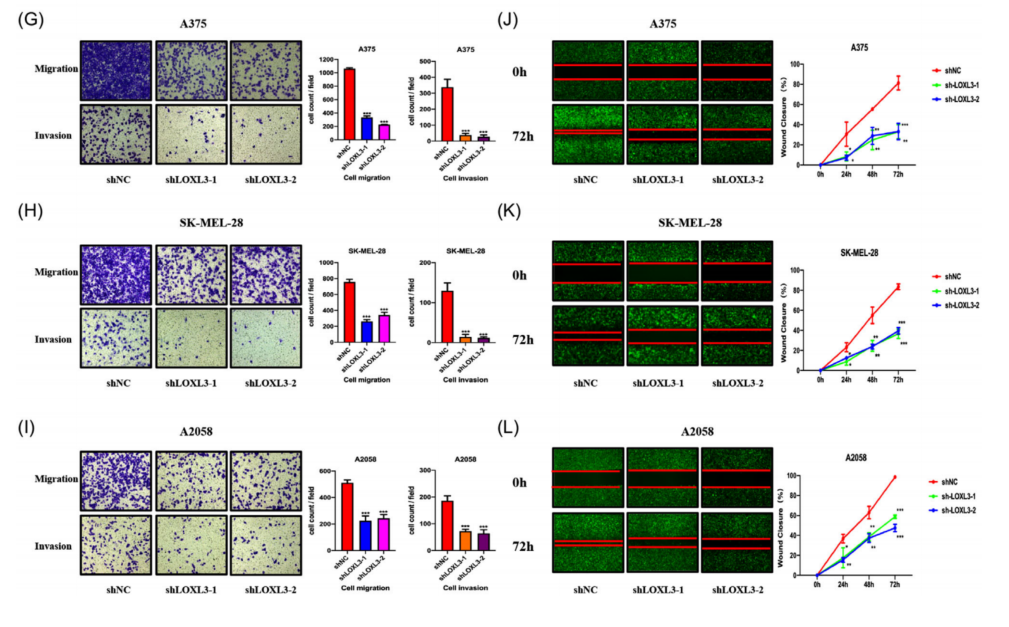
图7 下调LOXL3抑制黑色素瘤的迁移和侵袭
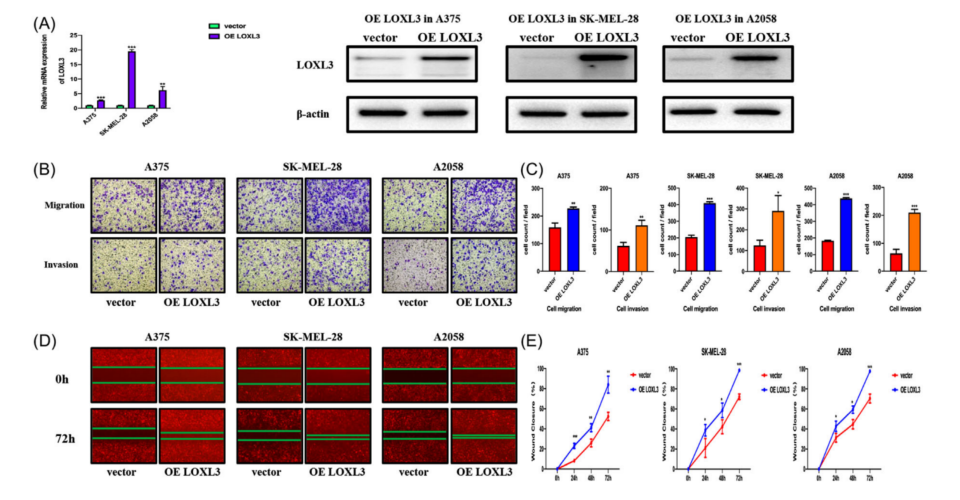
图8 LOXL3的过表达促进黑色素瘤的迁移和侵袭
7、LOXL3的过表达逆转了YTHDF3敲低引起的黑色素瘤迁移和侵袭的抑制作用
为进一步了解LOXL3的作用及YTHDF3对其的调控,逆转了LOXL3在YTHDF3-下调(shYTHDF3-1) A375、SK-MEL-28和A2058黑色素瘤细胞中的表达。本研究将慢病毒载体转染到shNC和shYTHDF3细胞中,并将LOXL3过表达的慢病毒转染到其他shYTHDF3细胞中。建立shNC/vector、shYTHDF3/vector和shYTHDF3/oeLOXL3三个细胞组。通过RT-qPCR和Western blot检测LOXL3过表达效率(图8F)。通过transwell实验(图8G-I)和创面愈合实验(图8J-L)发现,逆转LOXL3表达后,YTHDF3下调的A375、SK-MEL-28和A2058黑色素瘤细胞的迁移和侵袭能力得到一定程度的恢复。这些结果表明,通过其m6A结合位点,LOXL3不仅在黑色素瘤的迁移和侵袭中具有致癌作用,而且还是YTHDF3的重要“执行者”(图9)。
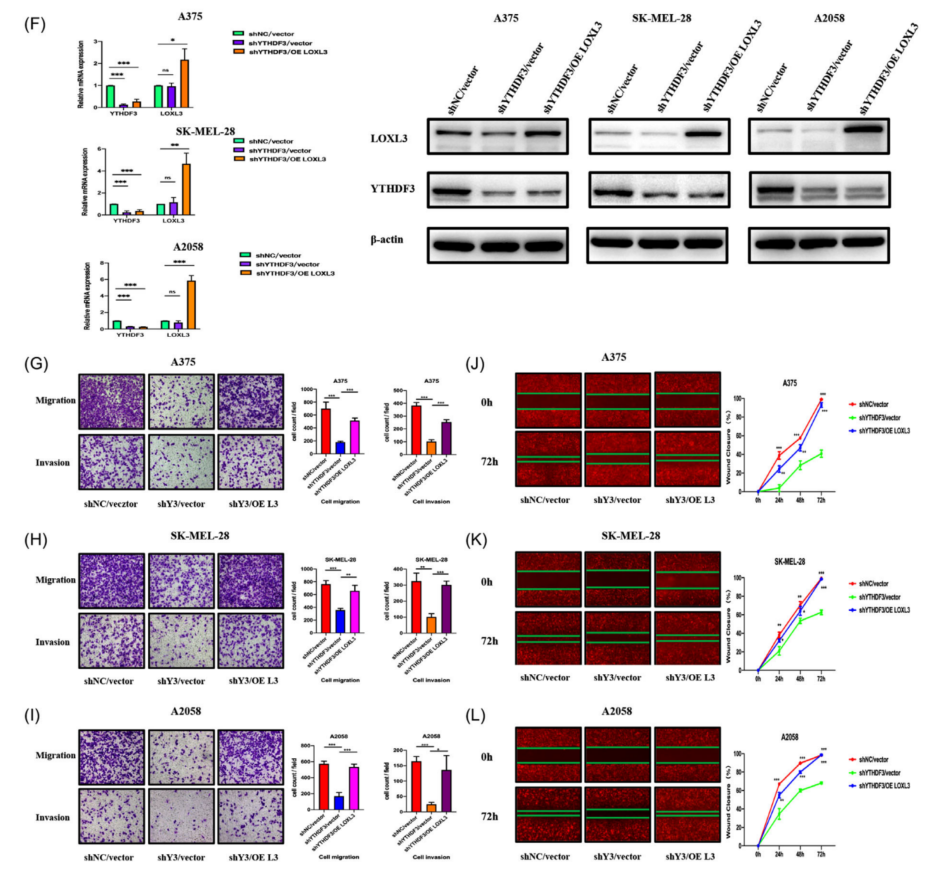
图8 LOXL3的过表达促进黑色素瘤的迁移和侵袭
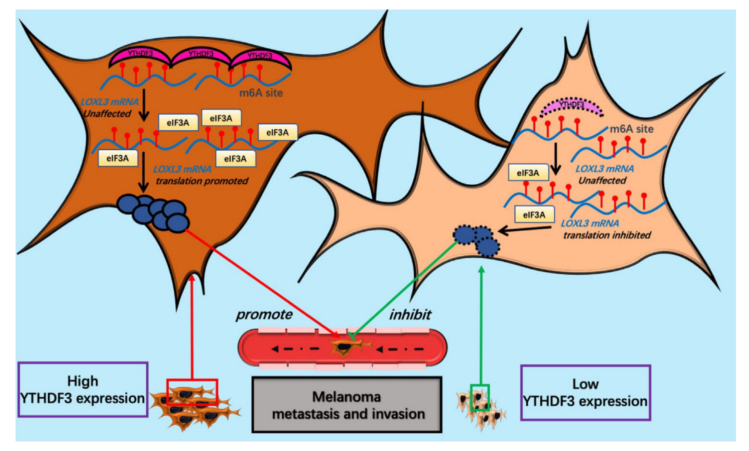
图9 黑色素瘤中YTHDF3调控LOXL3的示意图
三、研究结论
LOXL3的转录本通过m6A结合位点被YTHDF3捕获和调控。YTHDF3 通过在 LOXL3 转录本上富集真核翻译起始因子 3 亚基 A (eIF3A) 来增强 LOXL3 的蛋白表达而不影响其 mRNA 水平。YTHDF3通过LOXL3调控黑色素瘤迁移和侵袭等恶性行为。YTHDF3-LOXL3轴可以作为抑制黑色素瘤转移的潜在靶点。
参考文献:
N6-methyladenosine reader YTHDF3 regulates melanoma metastasis via its ‘executor’ LOXL3.[J]Clinical And Translational Medicine, 2022.