| 时间:2024-01-04 |
2023年发表于《Fertility And Sterility》(IF =6.7)
一、研究背景
肥胖现已成为一种常见疾病,会增加生殖内分泌疾病的风险,包括男性性征异常、多囊卵巢综合征(PCOS)、流产和不育等。原始卵泡是雌性哺乳动物生殖细胞的存在形式,原始卵泡有三种命运:激活成熟、保持休眠状态(大部分细胞)和直接死于休眠状态。在生理和病理条件下,原始卵泡的死亡和激活都是原始卵泡耗竭的表现,然而原始卵泡衰竭的主要原因尚不清楚。铁死亡是铁依赖性磷脂(PL)过氧化调节的细胞死亡的一种形式,脂质和致命活性氧的过度积累导致铁死亡。卵巢单细胞RNA测序显示,围产期卵母细胞丢失与铁死亡有关。然而,铁死亡在原始卵泡向初级卵泡转变(PPT)中的作用及其对原始卵泡消耗的作用仍然未知。本研究在建立小鼠肥胖模型的基础上,结合卵巢组织激光切割获得个体原始卵泡和初代卵泡,发现肥胖小鼠原始卵泡向初级卵泡转变(PPT)期铁死亡信号通路成分显著升高。
二、研究结果
1、高脂肪饮食(HFD)小鼠原始卵泡加速耗竭
为了研究肥胖小鼠卵巢的卵泡发育情况,建立了HFD喂养的小鼠(图1A)。在连续12周食用高脂肪饮食后,结果显示HFD小鼠的体重比ND小鼠明显增加(图1B)。此外,HFD小鼠的卵巢/体重比增加(图1C)。此外,HFD小鼠的胆固醇和空腹血糖水平高于正常饮食(ND)小鼠(图1D、E)。以上结果表明HFD小鼠模型建立成功。为了明确HFD小鼠的卵泡储备情况,制备了冷冻卵巢组织切片(图1F),并计算了卵巢中卵泡的数量(图1G)。油红O染色结果显示,HFD小鼠的原始卵泡和初级卵泡的脂质均有所增加(图1H)。图1I显示,HFD小鼠的原始卵泡数量与ND小鼠相比明显减少。然而,HFD小鼠的PPT和原代卵泡数量增加。ND和HFD小鼠的次级卵泡和窦状卵泡数量没有差异。此外,观察到HFD小鼠卵巢中闭锁卵泡数量增加(图1G)。
此外,检测了ND和HFD小鼠原始卵泡和初代卵泡周围颗粒细胞的增殖(图1H)。结果显示,HFD小鼠原代卵泡周围标记BrdU的颗粒细胞数量多于ND小鼠。相比之下,HFD和ND小鼠原始卵泡周围BrdU阳性信号无显著差异(图1I)。上述结果表明HFD小鼠颗粒细胞增殖和原始卵泡耗竭增加。
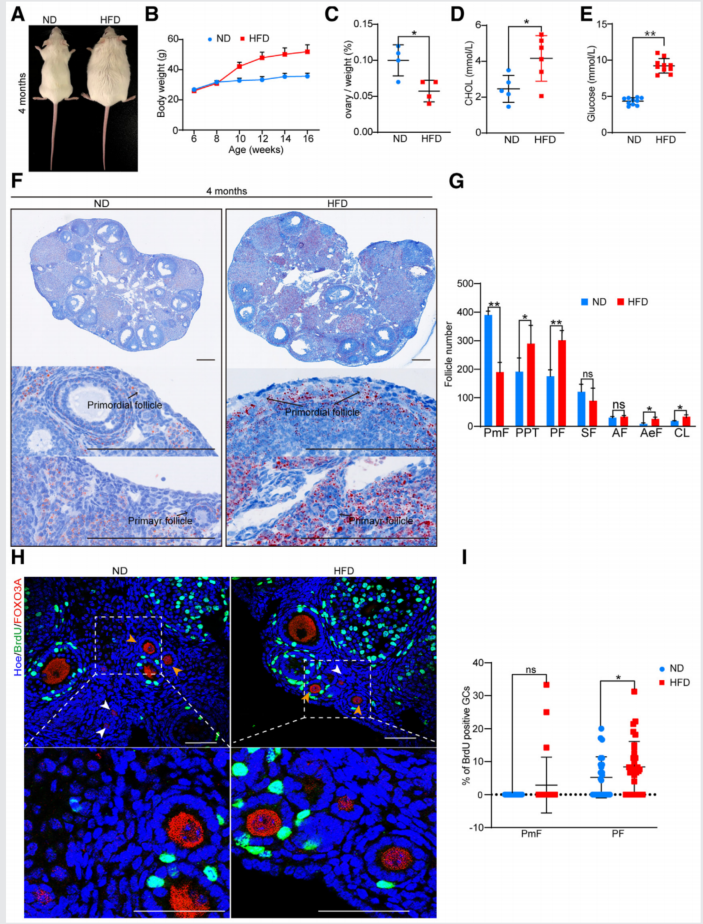
图1 HFD小鼠原始卵泡耗竭加速
2、ND和HFD小鼠原始卵泡和初级卵泡的转录谱
为了确定HFD小鼠原始卵泡衰竭的相关基因变化,本研究通过激光捕获显微切割收集了ND和HFD小鼠的原始卵泡和初级卵泡进行单细胞测序分析(图2A)。图2B的PCA分析区分了ND_原始卵泡、ND_初级卵泡、HFD_原始卵泡和HFD_初级卵泡组之间的差异。图2C和图2D的火山图分析了ND_原始卵泡和HFD_原始卵泡组(图2C)以及ND_初级卵泡和HFD_初级卵泡组之间的显著差异。在ND_原始卵泡中,细胞氧化应激水平和代谢相关基因,如Ndufb6、Mipep和Ube2m显著下调。在HFD_原始卵泡滤泡中,细胞氧化应激和代谢相关基因的水平,Tmigd1、Slx4ip和Masp2显著上调(图2C)。对于ND_初级卵泡,细胞增殖相关基因的水平,KCTD10、Slc2a8、Pla2g4f显著下调(图2D)。这些结果表明,HFD小鼠原始卵泡损耗的加速可能与细胞增殖、代谢和氧化损伤有关。
此外,与ND_初级卵泡相比,ND_原始卵泡中细胞能量和细胞周期相关基因Zfp692、Nup85和Gdpd2显著下调(图2E)。此外,细胞生长和分化相关基因Oas2、Tectb、Acbd4和Gcnt3显著上调。与HFD_初级卵泡相比,在HFD_原始卵泡中,细胞分化相关基因Gdpd2、Npm2、Mrm3和METTL23显著下调(图2F)。有趣的是,负责上皮细胞结构完整性的Krt19显著上调,这表明许多细胞类型可能与HFD_初级卵泡相关(图2F)。以上结果也表明,细胞增殖和分化是PPT的重要调控因素。
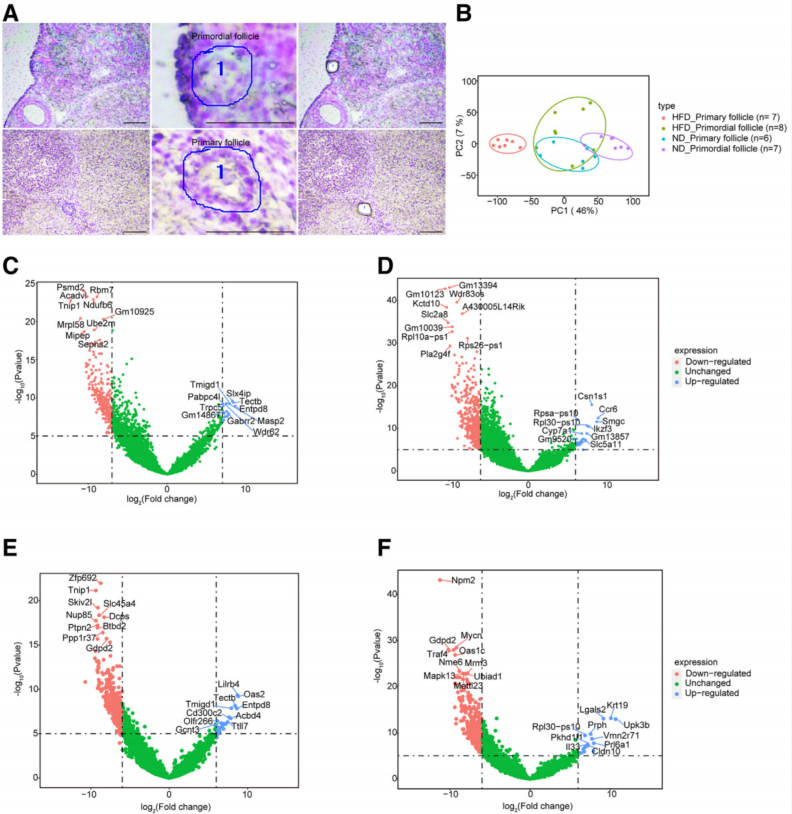
图2 ND和HFD小鼠原始和初级卵泡的转录谱
3、参与ND和HFD小鼠原始耗竭的信号通路
通过GO和GSEA分析比较ND和HFD小鼠的原始和初级卵泡(图3)。GO分析显示在HFD小鼠的原始和初级卵泡中,氧化应激、肽代谢和线粒体组织反应显著富集(图3A)。此外,与HFD小鼠的原始卵泡相比,ND小鼠的初级卵泡中的血管形态下调。GSEA的功能通路富集结果显示,在HFD小鼠的原始卵泡和初级卵泡中,铁死亡、细胞氧化应激、哺乳动物雷帕霉素靶点(mTOR)信号传导和血管内皮生长因子(VEGF)显著富集。这些信号通路可能介导原始卵泡向初级卵泡的转变,也可能是肥胖导致原始卵泡耗竭增加的分子机制。
用同样的方法比较ND小鼠和HFD小鼠的原始和初级卵泡。发现DNA转录、脂蛋白转运、T细胞活化和细胞分裂等生物学过程在ND小鼠的初级卵泡中显著富集(图3B)。然而,HFD小鼠的原代卵泡中细胞生长、有丝分裂和脂肪代谢过程的调控也被显著上调。此外,与原始卵泡相比,细胞氧化应激和Hedgehog信号通路在ND和HFD小鼠的初级卵泡中大量表达(图3B)。这可能意味着成年小鼠卵巢的PPT也需要外部信号。
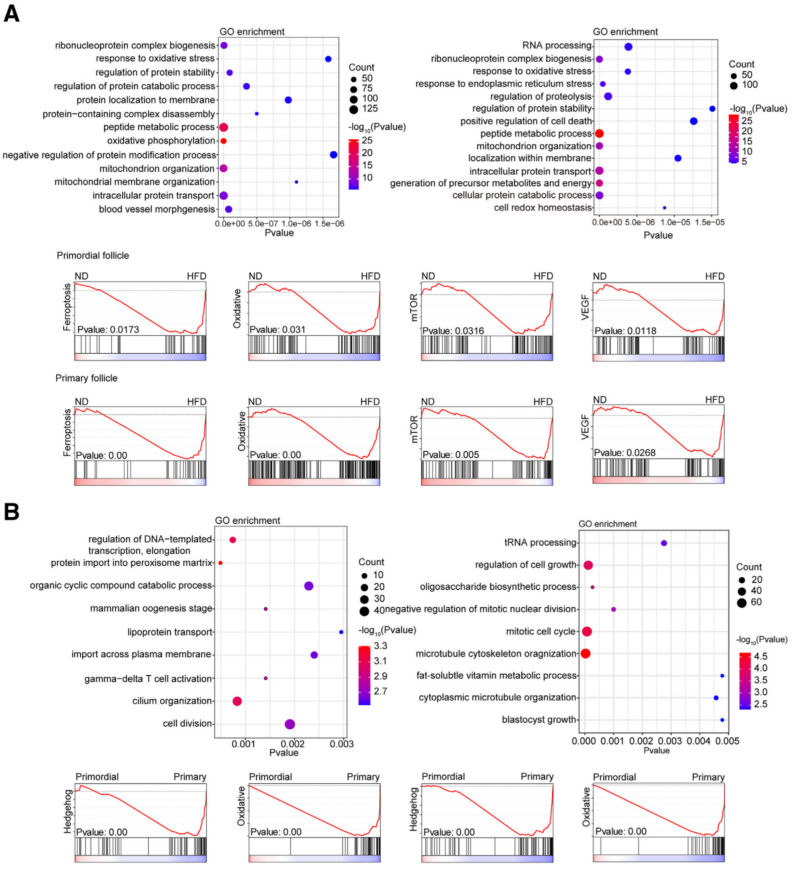
图3 参与ND和HFD小鼠原始耗竭的信号通路
4、ND和HFD小鼠中原始卵泡向初级卵泡转变(PPT)相关基因表达的变化
为了研究PPT过程中卵母细胞与颗粒细胞之间的相互作用,分析了卵母细胞特异性转录因子、卵母细胞-颗粒细胞交互(包括KITL/KIT信号通路、间隙连接、notch信号通路和TGFb信号通路)、mTOR信号通路和生长因子的表达,结果显示,HFD小鼠的PPT速率加快。 数据显示,igla、Sohlh1、Lhx8、Nobox、YY1、Kit、Kitl、Bmpr2、Id3持续高表达。Gjc1、Gja5、Jag1、Notch2、Hes1、Dll3的表达水平降低。mTOR信号通路也广泛参与PPT,其中mTOR、Tsc2、Rps6、Foxo3的表达水平高于PTEN的水平。
此外,许多生长因素驱动PPT,包括白血病的表达水平抑制因子(liff)、脑源性神经营养因子(Bdnf)、Bdnf /NT-3生长因子受体(Ntrk2)、促表皮生长因子(Egf)在HFD小鼠中的表达水平降低,而血管内皮生长因子A (Vegfa)和血管内皮生长因子B (Vegfb)的表达水平升高。这些数据表明VEGF可能是HFD小鼠PPT的关键调节因子。总之,本研究结果证明HFD小鼠的PPT是由自分泌和旁分泌信号通路协调的,这些信号通路可以通过卵母细胞、颗粒细胞或周围微环境的变化来启动。
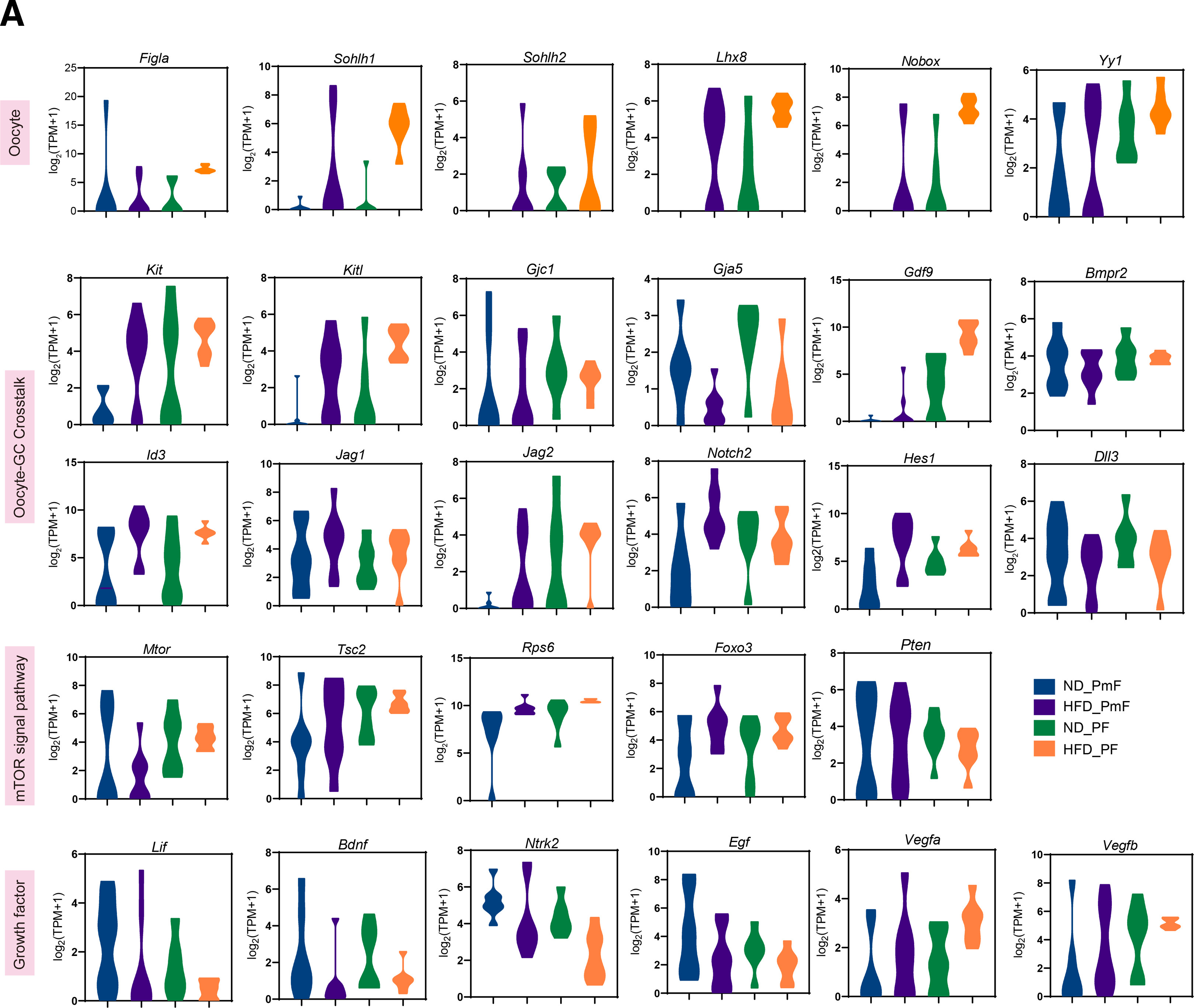 补充图1 ND与HFD小鼠间PPT相关基因表达的变化
补充图1 ND与HFD小鼠间PPT相关基因表达的变化
5、ND和HFD小鼠之间的转录因子调控网络
为了探索ND和HFD小鼠原始和初级卵泡的转录调控网络,使用精确的细胞网络重建算法ARACNe方法分析了小鼠中已知的1636个TF。Tcf7l1、Zhx1在HFD喂养小鼠的原始卵泡中表达上调。 HFD小鼠初级卵泡中Foxl2、Tef、Tcf7l1的表达上调。Zfp948、Baz2b、Hlx、Zeb2、Zic1在ND小鼠的初代卵泡中高表达,表明这些TF可能是导致ND与HFD小鼠原始卵泡和初代卵泡差异的关键因素。另外,发现Tcf7l1在HFD小鼠的原始和初级卵泡中均上调,这表明Tcf7l1可能在肥胖引起的原始卵泡耗竭异常中调节转录网络。
此外,Plagl2、Zfhx4、Nme2在ND小鼠初级卵泡中表达上调,提示它们可能是ND小鼠初级卵泡的调控因子。Nfib在HFD小鼠初级卵泡中的表达水平高于HFD小鼠原始卵泡,表明其可能在HFD小鼠初级卵泡中发挥重要作用。对这些TF的进一步分析将有利于肥胖诱导的原始卵泡耗竭的转录控制机制研究。
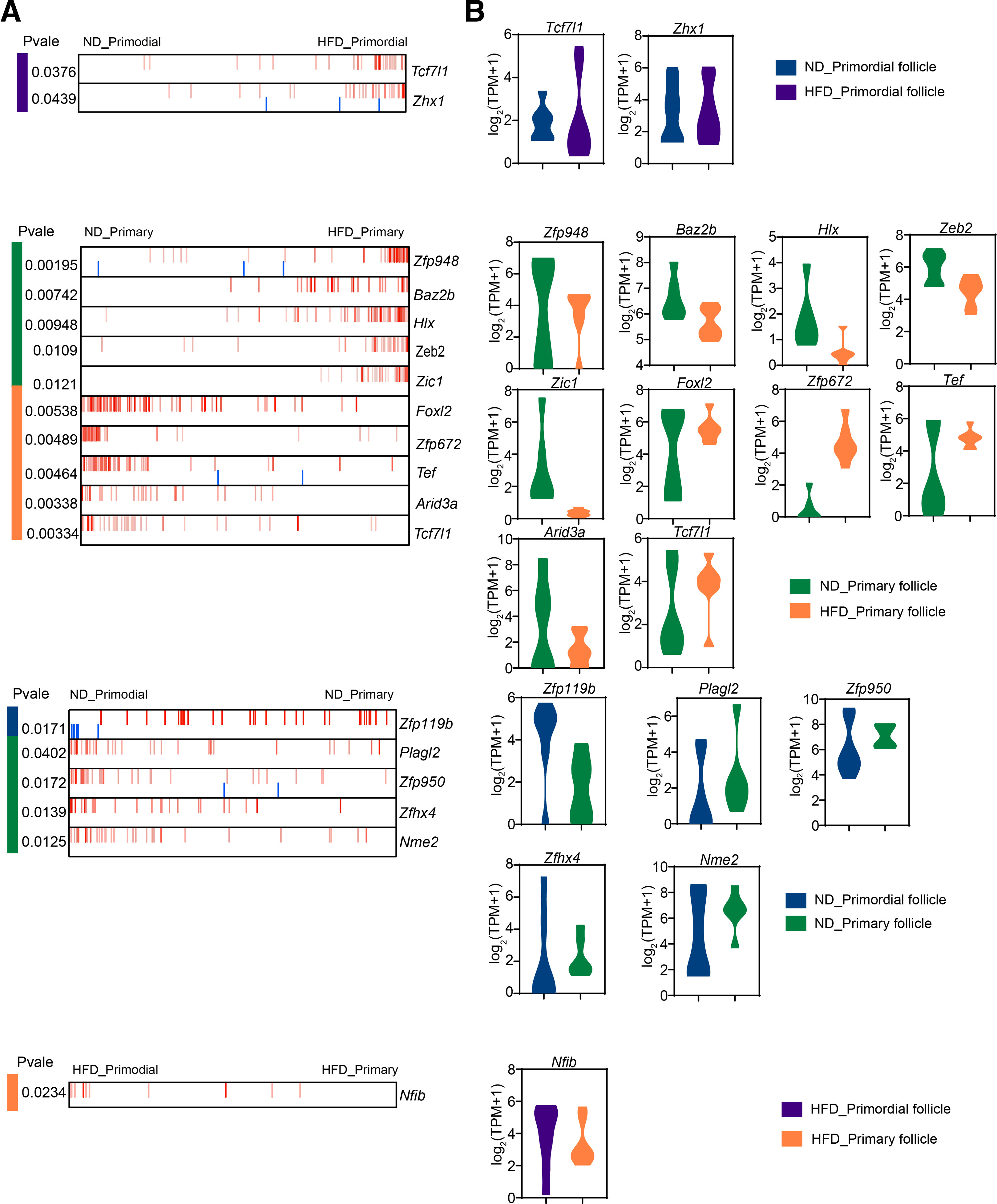
补充图2 ND和HFD小鼠之间的转录因子调控网络
6、HFD小鼠中铁死亡信号通路被激活
在GO和GSEA分析的基础上,发现HFD小鼠原始卵泡和初级卵泡中与铁死亡相关的一些特异基因显著上调(图4)。我们对原始卵泡和PPT卵泡进行免疫荧光染色,观察铁死亡蛋白的变化。结果表明,铁蛋白、ACSL4、SLC7A11和GPX1定位于细胞质中(图4A)。此外,在HFD小鼠的原始卵泡和激活卵泡中,铁蛋白、ACSL4和SLC7A11的表达上调(图4B)。此外,ND小鼠从原始卵泡向初级卵泡过渡时,GPX1的表达下调(图4A)。这表明GPX1是一个关键的调节因子。因此,推测铁死亡是导致HFD小鼠原始卵泡耗竭的关键信号通路。
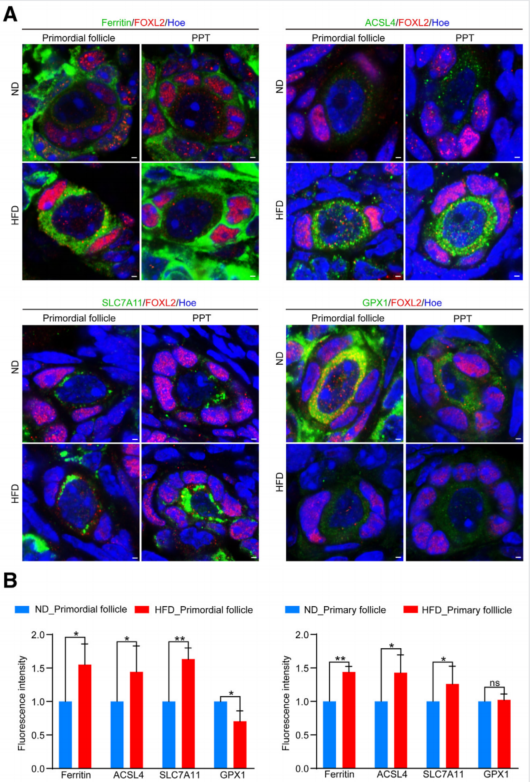
图4 HFD小鼠的铁死亡信号通路增加
三、研究结论
Tcf7l1可能在肥胖引起的原始卵泡耗竭异常中调控转录,而铁死亡是导致HFD小鼠原始卵泡耗竭的关键信号通路,为阐明原始卵泡衰竭的潜在机制研究提供了一定的理论基础。
参考文献:
The transcriptome reveals the molecular regulatory network of primordial follicle depletion in obese mice.[J]Fertility And Sterility, 2023.