| 时间:2023-11-03 |
2021年发表于《Molecular Therapy-Nucleic Acids》(IF =8.8)
一、研究背景
青春期性成熟由激素调控,是哺乳动物个体发育的重要阶段。青春期的激素分泌受下丘脑-垂体-性腺轴控制,由下丘脑促性腺激素释放激素(GnRH)神经元分泌GnRH,进而刺激男女性产生相应激素。GnRH的分泌受5-羟色胺(5-HT,色氨酸的代谢物)调控,5 -羟色胺在生殖激素分泌调控中起重要作用。5-HT作为一种抑制性神经递质,对绵羊和大鼠的青春期具有抑制性影响;而5-HT受体(5-HTR)抑制剂可增强GnRH神经元的兴奋性。不同的HTR亚型使得5-HT有不同的作用,其中HTR1和HTR5参与抑制神经元放电,而其他则是兴奋性受体亚型。然而,5-HT控制的GnRH分泌与HTRs的作用机制尚不清晰。
本研究在体内检测了雌性小鼠下丘脑青春期HTR表达的动态变化,并进一了5-羟色步研究胺受体1A (HTR1A)对小鼠下丘脑神经元细胞GT1-7 GnRH转录的调控机制,GT1-7是体外稳定产生GnRH的细胞系。本研究揭示了HTR1A和GnRH表达之间的新的调控关系,说明了表观遗传在青春期调节GnRH转录的重要性。
二、研究结果
1、HTR1A的动态变化与GnRH释放密切相关
研究了小鼠在青春期不同阶段下丘脑中5-羟色胺受体的谱图。产后周(PNW)-3、-4和-8表示青春期前、青春期和青春期晚期的阶段,5-HTRs的mRNA水平显示,下丘脑的HTRs中HTR1A丰度最高。与PNW- 3相比,PNW-4和PNW-8中HTR1A显著下调,而HTR2C、HTR4和HTR7上调(图1A)。接下来重点研究下丘脑弓状核(ARC)上,它包含与青春期发育和GnRH分泌相关的神经元核。与mRNA水平一致,与PNW-3相比,PNW-4和PNW-8的下丘脑ARC中HTR1A蛋白显著下调(图1B)。
为进一步研究HTR1A在青春期发育调控机制中的作用,利用小鼠下丘脑神经元细胞系GT1-7进行体外研究。首先,GT1-7细胞经色氨酸和5-HT处理后,培养液上清中GnRH水平均降低,HTR1A表达增加,而HTR2C、HTR4和HTR7表达与对照组相比无明显变化(图S2A-S2D)。此外,用WAY-100635马来酸盐(HTR1A抑制剂)预处理后,色氨酸或5-HT刺激后的GT1-7细胞中,GnRH的转录和胞外分泌得以恢复(图1C和1D)。综上所述,确定HTR1A在体内和体外通过色氨酸代谢抑制GnRH释放。
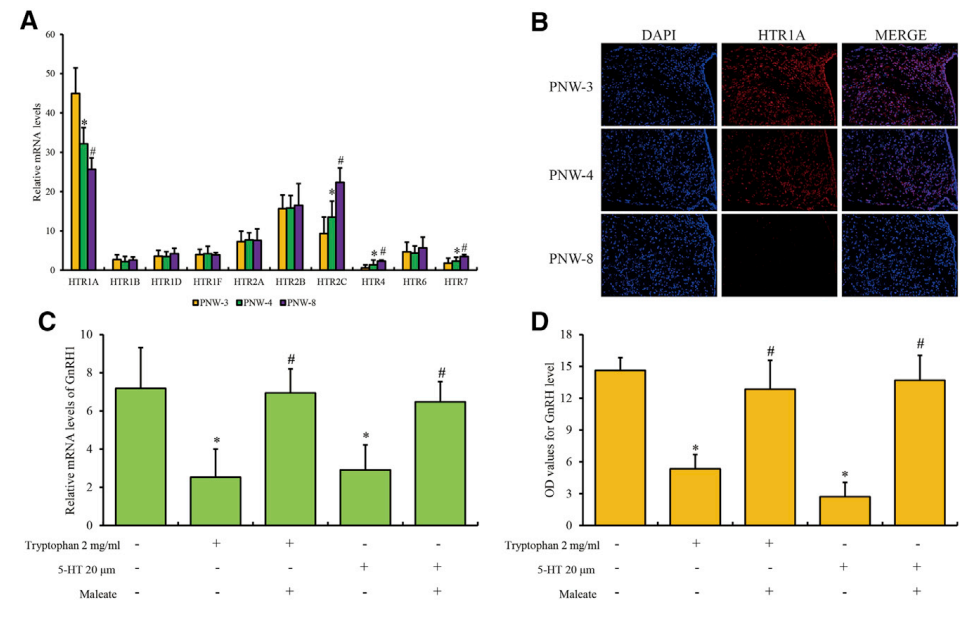
图1 HTR1A在ARC中的表达谱
2、HTR1A拮抗剂马来酸盐在GT1-7细胞中的转录谱分析
通过RNA-seq来研究马来酸盐对GT1-7细胞的转录谱的影响(图2A)。与阴性对照相比,GT1-7细胞中存在1287个差异表达基因,1029个编码基因上调, 259个基因下调(图2B)。 GNRH1表达上调,除了HTR3B和HTR5A外,其他HTRs的转录均无显著变化,这表明马来酸盐对HTR1A或其他大多数HTRs的转录没有影响。
GO分析表明,DEGs编码的蛋白质大部分分布在质膜或细胞外基质上,通过多种离子通道参与信号传递和有机交换,最终影响类固醇、醇类、胆固醇、酸类等多种物质的代谢过程和生物合成(图2C)。KEGG分析显示,磷脂酰肌醇3-激酶(PI3K)/Akt、Rap1、AMP活化蛋白激酶(AMPK)和丝裂原活化蛋白激酶(MAPK)信号通路与马来酸盐处理相关(图2D)。通过对GT1-7细胞的RNA谱分析,对马来酸盐诱导GnRH基因表达调控的潜在机制进行了概述。
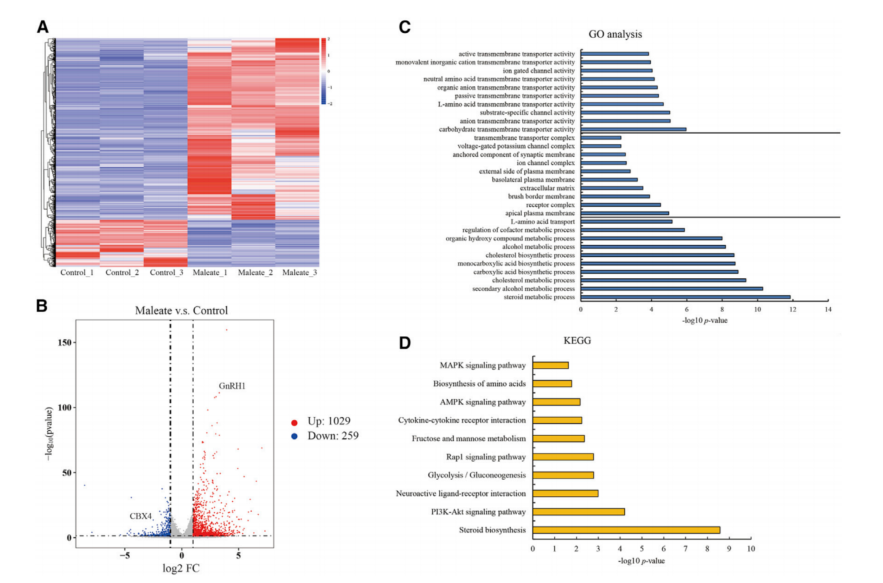
图2 马来酸盐处理GT1-7细胞的转录谱分析
3、马来酸盐通过下调chromobox4 (CBX4)的表达抑制多梳抑制复合物1 (PRC1)的合成
通过比较马来酸盐处理组和对照组的RNA-seq数据,发现CBX4下调。CBX4作为CBX蛋白家族的一员,通过募集环指蛋白2 (RING2)的PRC1亚基,参与PRC1的形成。假设马来酸盐降低CBX4的表达可能导致PRC1的破坏。为此,通过共免疫沉淀(coIP)检测PRC1的完整性。与对照组相比,在马来酸盐处理的GT1-7细胞中,CBX4与YY1转录因子(YY1)和RING2表达的相互作用减弱(图3A)。凝胶过滤实验也得到了类似的结果,与对照组相比,在马来酸处理的GT1-7细胞中,YY1和RING2蛋白的峰不在同一分数内(图3B和3C),表明PRC1由于CBX4表达的下调而减少。
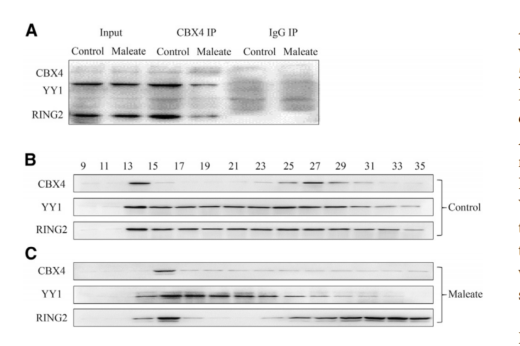
图3 CBX4在马来酸盐处理的GT1-7细胞中的表达
4、通过CBX4表达的缺失和H2AK119ub与GnRH启动子的结合,马来酸盐调节GnRH转录的增强
ChIP-seq研究马来酸盐对CBX4全基因组富集的影响。与对照组相比,在马来酸处理的GT1-7细胞中,CBX4的基因组结合明显减少(图4A);有354个差异显著的峰(图4B),有326个基因没有CBX4的峰富集,包括GNRH1、LEP、NCS1和SYCP1,以及多个与GnRH分泌和神经元电生理密切相关的溶质载体家族成员。同时也利用ChIP-seq研究了基因组的H2AK119ub的修饰,与CBX4类似,与对照组相比,马来酸盐处理的GT1-7细胞中H2AK119ub修饰也减少(图4C),共有228个基因中76个修饰上调,152个修饰下调(图4D)。

图4 用马来酸盐处理的GT1-7细胞中CBX4和H2AK119ub的全基因组富集
对CBX4和H2AK119ub差异富集基因取交集进行分析(图5A),共有的31个基因包括AGTPBP1、CCNG2、FOXK1、GNRH1、MEF2C和RBP4(图5B和5C)。马来酸盐处理后,GNRH1启动子区CBX4和H2AK119ub的富集减弱。为了证实CBX4表达对GnRH转录活性的影响,采用ChIP-qPCR研究了作为POLR2最大亚基的CBX4、H2AK119ub和RNA聚合酶II亚基A (POLR2A)在GnRH启动子上的富集情况。与PNW-3相比,在PNW-4和-8中CBX4和H2AK119ub富集减少,GNRH1启动子处POLR2富集升高(图5E)。总的来说,色氨酸代谢轴通过CBX4介导的表观遗传调控,从而影响GnRH基因表达。
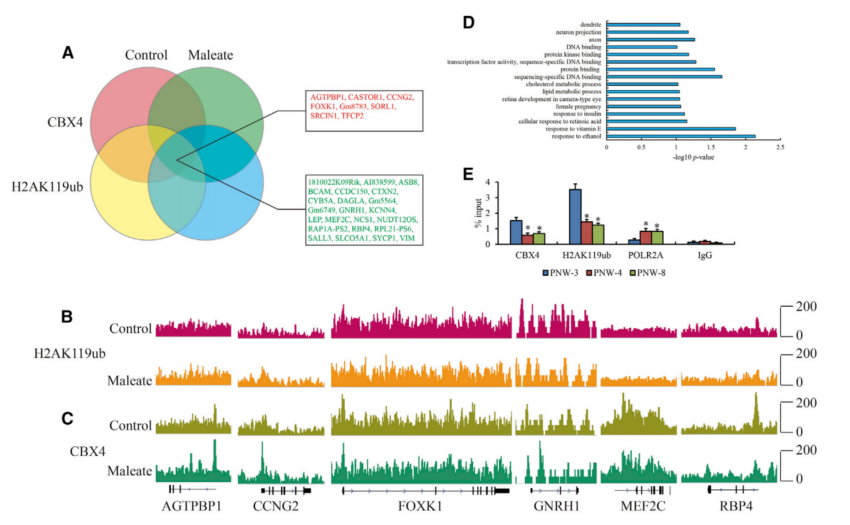
图5 用马来酸盐处理的GT1-7细胞中CBX4和H2AK119ub的富集
5、马来酸盐抑制PI3K/Akt对CBX4沉默的贡献
为了研究了GT1-7细胞中响应马来酸盐的调控网络,以建立HTR1A和CBX4之间的联系。根据最近研究结果,找到了包括负责HTR1A信号的PI3K/Akt、cAMP)/PKA和MAPK在内的信号通路,用小分子抑制剂或激活剂预处理GT1-7细胞,然后再使用马来酸盐处理。发现PI3K/Akt和MAPK/ERK是连接HTR1A和CBX4表达的重要途径,MAPK/ERK活性可能依赖于PI3K/Akt。同样,在马来酸处理的GT1-7细胞中,细胞核中Akt和ERK1/2的磷酸化显著降低,证实PI3K/Akt和MAPK/ERK均被马来酸盐抑制(图6D和6E)。
综上所述,这些结果表明,HTR1A的负信号阻断PI3K/Akt和MAPK/ERK通路,使CBX4转录被抑制,导致PRC1降解,减弱了H2AK119ub在GnRH启动子处的修饰,最终增强GnRH转录。本研究结果揭示了哺乳动物青春期过程中,色氨酸代谢对GnRH调节的一种新的调节机制,并为中枢神经系统衍生的性发育不良疾病提供了潜在的治疗策略。
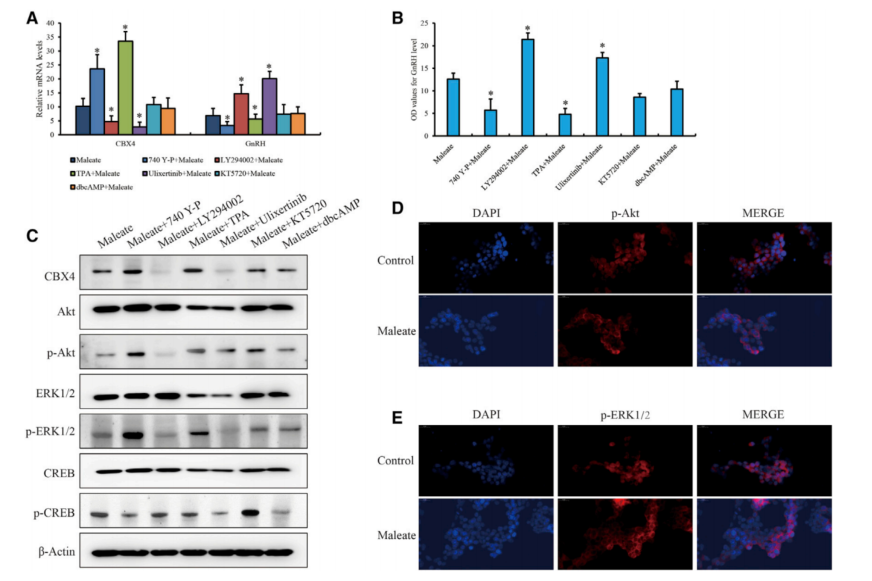
图6 马来酸盐诱导PI3K/Akt和MAPK/ERK通路的活性调控CBX4的表达
三、研究结论
HTR1A拮抗剂可以通过抑制GT1-7细胞中PI3K/Akt和MAPK/ERK途径,抑制CBX4表达,造成PRC1降解和H2AK119ub在GnRH启动子处的修饰减少,从而增强GnRH的转录,并提供了HTR1A在哺乳动物青春期开始时影响GnRH基因表达的潜在表观遗传机制。
参考文献:
The epigenetic role of HTR1A antagonist in facilitaing GnRH expression for pubertal initiation control.[J]Molecular Therapy-Nucleic Acids, 2021.