2021年发表于《Nature Communications》(IF =16.6)
一、研究背景
转录因子与增强子的结合是转录激活的关键步骤之一,许多基因通常受到多个增强子的调控,增强子的状态在不同的细胞类型中是不同的。因此,增强子通过活性变化如何调控信号通路和基因转录已成为一个重要的研究方向。最近在患者和动物模型中进行的一些研究,证实了癌症中增强子的活性会增加。许多与增强子活性的表观遗传调控相关的基因在癌症中经常发生突变,因此,需要研究清楚增强子在癌症中的作用及其潜在机制。
结直肠癌(CRC)是世界上最常见的癌症之一,为了建立CRC活性增强子的图谱,本研究对73对CRC组织(肿瘤组织和配对的癌旁组织)进行了H3K27ac ChIP-seq分析,并进行了相应的基因组和转录组测序。鉴定出数千个与CRC相关的增强子和多个TF,并对其中一部分进行了验证,这为CRC的未来研究提供了重要的表观基因组资源。
二、研究结果
1、结直肠癌(CRC)患者组织中增强子分布的全基因组研究
对74个结直肠癌组织和73个原生组织(其中73对癌症、癌旁组织配对样本)进行了多组学测序,生成147个H3K27ac的 ChIP-seq、144个RNA-seq、147个全基因组测序和86个H3K4me3 ChIP-seq测序结果。癌旁组织组织中共有27,156个显著增强子,在肿瘤组织中有39,207个显著增强子,大部分分布在内含子和基因间区域(图B)。饱和度分析显示,使用40对样本进行分析时,肿瘤中获得的增强子达到80%,而使用50对样本进行分析时,获得的增强子达到90%,表明本研究的样本量足以进行统计分析(图C)。RNA-seq分析确定了CRC肿瘤中2226个上调的差异表达基因(deg)和1979个下调的差异基因(图D)。
在癌旁组织中,MYC表达极低,其增强子上的H3K27ac信号与eRNA接近背景信号;在肿瘤组织中,MYC高表达,其增强子上的H3K27ac信号和eRNA表达的升高(图E)。与20个COAD细胞系(GSE77737)的比较研究发现,本研究在CRC中发现了11796种特有的活性增强子,占总增强子的32.4%(图F, G)。
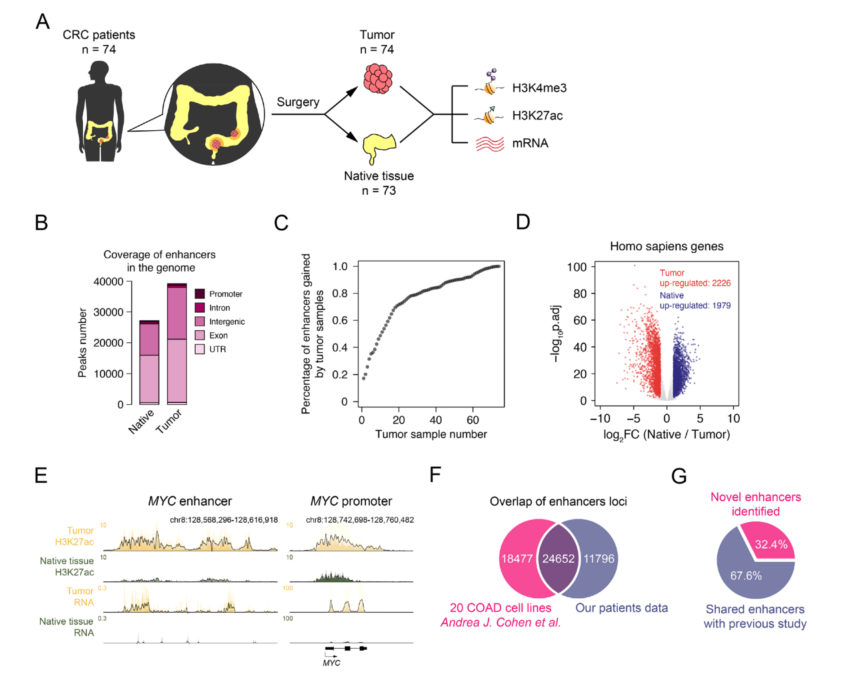
图1 CRC患者组织中活性增强子的注释
2、CRC中发生变化的增强子位点的鉴定
为了确定肿瘤异性的活性增强子,分析了所有样本的增强子,识别鉴定出5590个获得的差异增强子位点(gain VELs)和1100个缺失的差异增强子位点(lost VELs)(图2A)。靠近IL20RA和FOXQ1的获得的差异增强子位点(gain VELs)(图2C)。鉴定出的差异增强子位点可以很好地区分原生组织和肿瘤组织(图2A)。GO分析表明差异增强子位点的相关基因与CRC高度相关(图D),而缺失的差异增强子位点的相关基因与正常结肠功能相关。
为了进一步评估H3K27ac或增强子信息在区分肿瘤组织和正常组织中的潜力,利用基因表达信息、增强子上的H3K27ac信号和启动子上的H3K4me3信号,对癌旁组织和肿瘤组织进行PCA聚类。使用基因表达或显著增强子的H3K27ac信号可以很好地区分相邻和肿瘤样本(图E-G)。
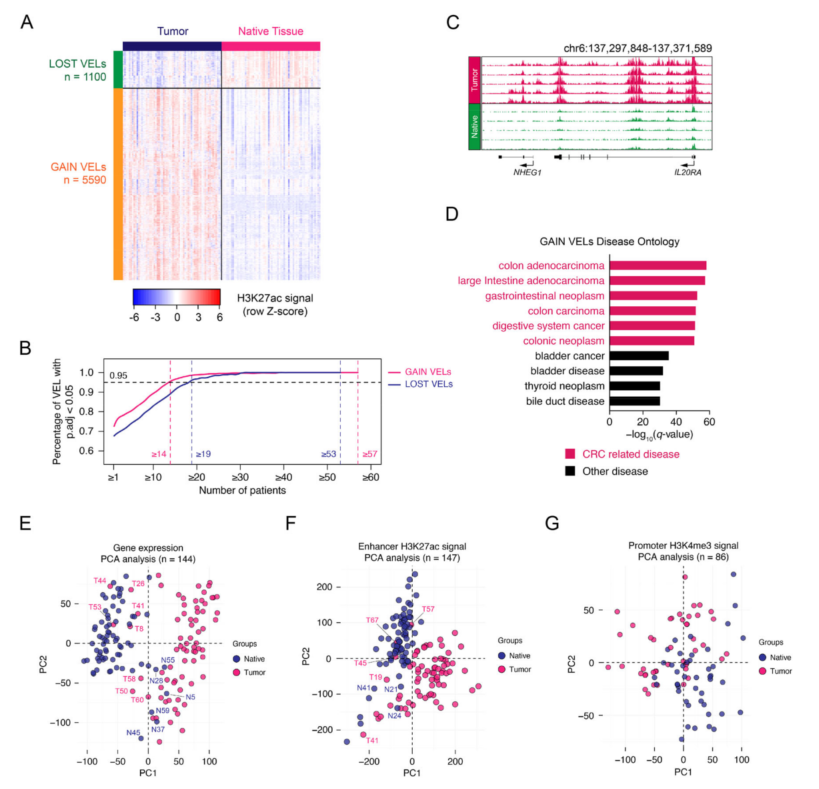
图2 CRC中发生变化的增强子位点的鉴定
3、CRC亚群的增强子特征
为了进一步研究CRC亚群中的增强子特征,使用CRC肿瘤的共识分子亚型(CMS)分类方法,将患者分为四个亚群(图3A和3B)。基于鉴定到的增强子位点(VELs)和亚群特异性增强子位点的相关性分析显示,CMS2组的组织相关性最高,而CMS4组的组织相关性最低(图C和D),表明CMS4可能比其他组更具异质性。比较四个亚组中的增强子时,CMS2中显著gain VELs数量最多、gain VELs区域的H3K27ac信号最强和亚群特异性gain VELs数量最多(图E-G)。
对于CMS2,发现其特异性gain VELs相关基因主要参与WNT信号传导、细胞迁移和脂质代谢过程(图H)。由于APC是结直肠癌中最常见的突变基因之一,而细胞迁移是癌细胞的一个标志,因此WNT信号的激活和细胞迁移的增强在结直肠癌中是可预期的。脂质代谢与结直肠癌有关,但不同组的结果不一致。本研究分析表明脂质代谢稳态失调可能与某些结直肠癌亚群有关。图3I显示了CMS2亚组一些基因的表达水平,如CEL和DPEP1(图3I)。
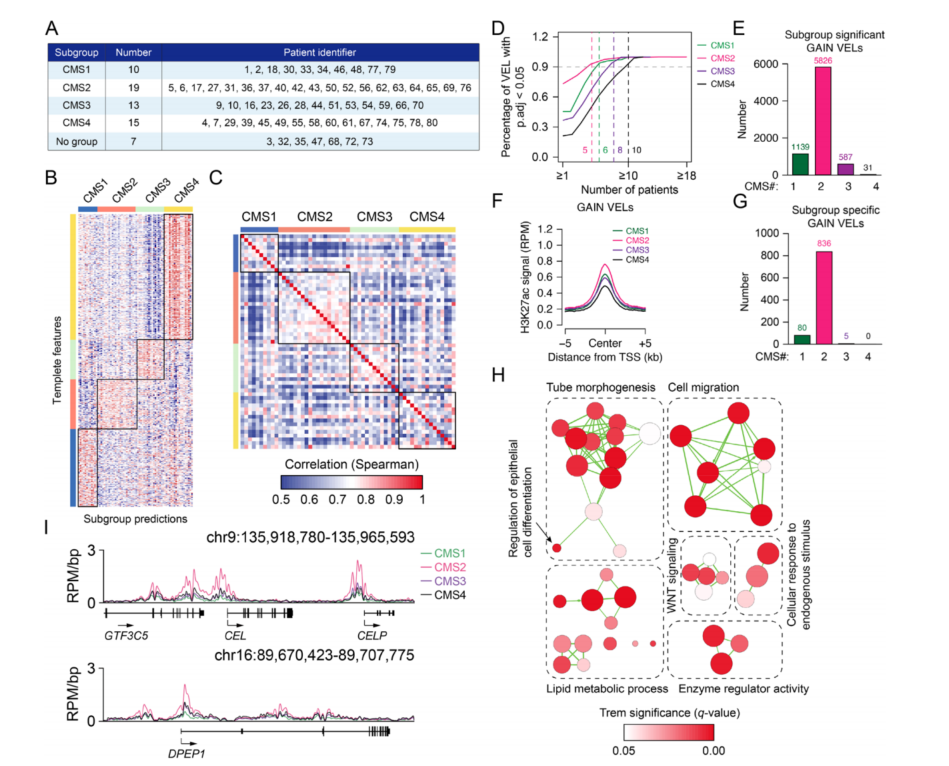
图3 CMS亚群中增强子的特性
4、变异超级增强子位点的分析与验证
癌基因相关超级增强子的激活是癌症的重要特征之一。使用与VEL鉴定相似的方法,在肿瘤组织中鉴定了334个获得的变异超增强子位点(VSEL)和121个缺失的变异超增强子位点(VSEL),还鉴定了几个致癌靶点,如MYC、VEGFA和LIF(图4A)。与预期一样,获得VSELs上的H3K27ac水平显著升高,而缺失VSELs上的H3K27ac水平显著降低(图4B和4C),获得VSELs相关基因的表达高于缺失VSELs相关基因。
通过比较结直肠癌组织顶部血管内皮细胞上的H3K27ac谱与HCT116细胞中的H3K27ac谱,验证了所鉴定的血管内皮细胞的功能。选择HCT116中出现的获得VSELs,利用dCas9-KRAB体系抑制增强子活性。为每个SE设计多个sgRNAs 和稳定细胞系HCT116、SW620或RKO三个CRC细胞系(图4D)。在分析的11个 SEs中,有10个SEs调控其近端基因的表达,包括IER3、LIF、SLC7A5、CYP2S1、PHF19、 RNF43、CEBPB、TBC1D16、TNFRSF6B、VEGFA(图4A和4E)。对于某些增强子,多个相近基因的表达被抑制。与它们在结直肠癌患者组织中的表达进行比较,表明上述SE调控了相应基因的表达。
此外,本研究在HCT116中建立了稳定的抑制增强子细胞系,并研究了它们的增殖和迁移能力。沉默PHF19、LIF、SLC7A5、CYP2S1、RNF43、VEGFA和TBC1D16后,细胞增殖和细胞周期的差异不是很显著,但表现出迁移能力减弱(图4F)。为了进一步研究上述SEs在结直肠癌中的功能,对稳定的HCT116细胞进行了异种移植实验,结果表明抑制PHF19和TBC1D16 SEs可显著降低肿瘤生长,并在随机选择的肿瘤中验证了靶基因的表达(图4G-I)。
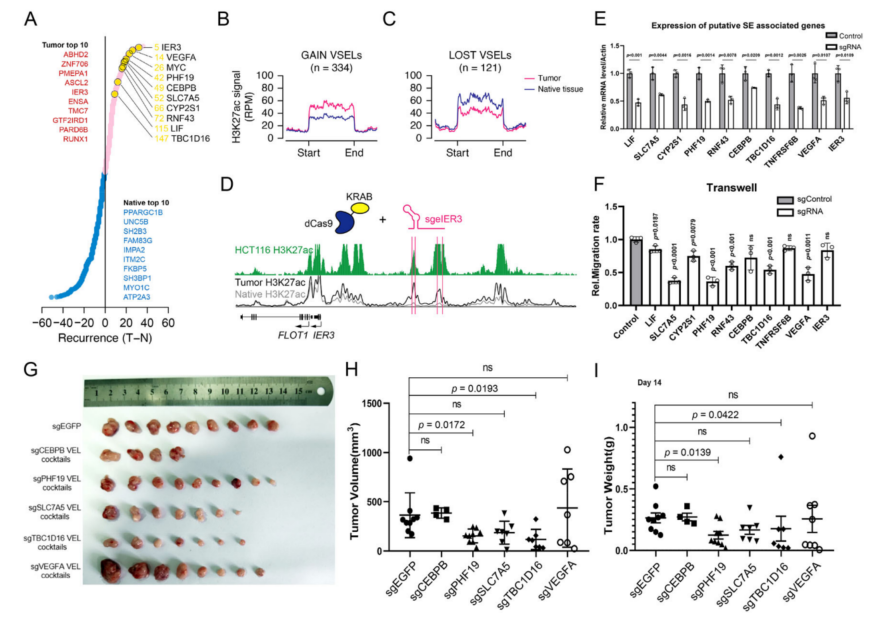
图4 肿瘤特异性超级增强子在结直肠癌中的作用
5、功能性转录因子的预测与验证
为了研究在结直肠癌中发挥关键作用的潜在转录因子(TFs),使用HOMER软件对VEL的DNA序列进行预测。列出了获得和缺失水平的最高命中数(图5A)。利用核心调控回路方法识别CRC组织中的关键TF(图5B、5C)。ASCL2被预测为CRC特异性TF,评分最高(图5C)。ASCL2增强子H3K27ac水平在肿瘤中显著升高,基于TCGA数据集的基因表达分析显示ASCL2在结直肠癌中具有高特异性表达。这表明ASCL2是CRC的关键TF,这与之前的研究结果一致,没有进一步研究ASCL2的作用。
结合以上结果和已发表的文献,选取了10个左右的TF进行实验验证。最终,只成功敲除了4个基因,包括KLF3、MAFK、MAZ和RUNX1。在细胞增殖试验中,敲低这些基因不影响细胞增殖;而KLF3、MAZ和RUNX1被siRNA敲低,或被CRISPR/sgRNAs敲低KLF3,抑制细胞迁移,但不抑制MAFK(图5D和5E)。因此,确定了KLF3是参与CRC的TF,并证实了RUNX1和MAZ的作用。尽管在DNA基模分析中预测了MAFK,实验结果没有发现MAFK在增殖或迁移中起作用,这表明但它并不参与CRC。为了进一步证实KLF3的功能,在HCT15和RKO细胞系中使用CRISPR/sgRNAs敲除KLF3,观察到相似的结果。然后用KLF3缺失的HCT116进行异种移植实验,结果表明KLF3敲低抑制了小鼠的肿瘤生长(图5F-5H)。
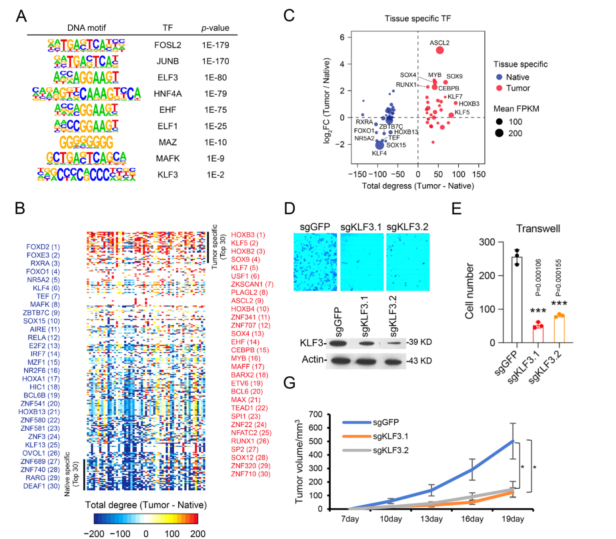

图5 CRC能性转录因子的预测
三、研究结论
利用ChIP-seq、RNA-seq和基因组测序等多组学测序,通过基序(motif)分析和核心调控回路分析预测了结直肠癌的多个关键转录因子,验证了调控PHF19和TBC1D16的超级增强子在结直肠癌肿瘤发生中的调控作用,KLF3被确定为结直肠癌的致癌转录因子。本研究为结直肠癌表观遗传学研究提供了重要的表观基因组资源和功能因子。
参考文献:
Genome-wide profiling in colorectal cancer identifies PHF19 and TBC1D16 as oncogenic super enhancers.[J]Nature Communications, 2021.





