| 时间:2023-10-17 |
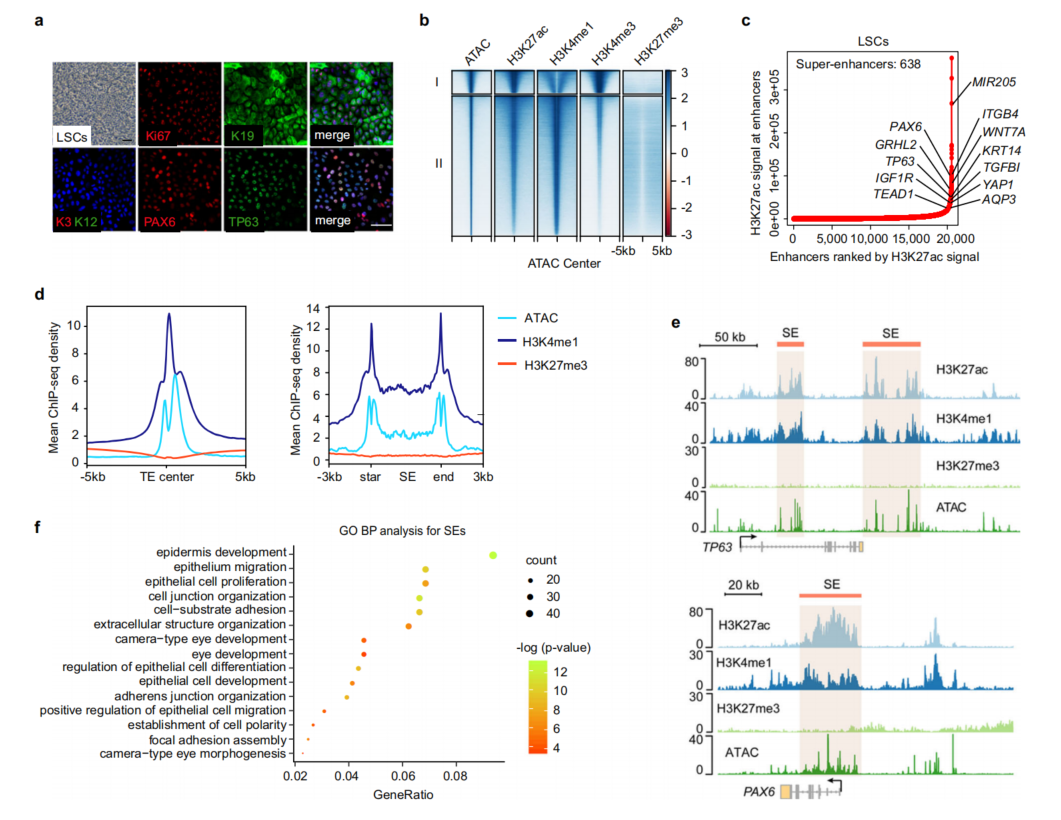
图1 原代LSCs的组蛋白修饰和染色质可及性景观
补充图1b ATAC、H3K27ac、H3K4me1、H3K4me3、H3K27me3分布模式条形图
2、LSCs(角膜缘干细胞)的CRCs(核心转录调控回路)分析
进一步研究SE和细胞类型特异性TF的关系发现,SE和开放染色质区域通常在细胞类型特异性TF周围高度富集。通过整合H3K27ac和ATAC数据,进一步构建了SE介导的LSCs转录调控模型(图2a)。通过in-degree(与节点TF的SE结合的TF数量)和out-degree(与节点TF结合的SE数量)值量化TF节点之间的网络连通性,揭示了一组关键TF,包括PAX6、RUNX1、SMAD3、JUNB、FOSL2、TP63、KLF4、SOX9、EHF、TEAD1和KLF5(图2b)。它们中的大多数也是其他鳞状上皮组织的核心调节因子。TP63连接了高连接度的调节因子,这些调节因子对分层上皮的发育、增殖和分化很重要(图2c)。分层相关TF的基序,如TP63, KLF7,SOX9、KLF4和KLF5同时富集于它们基序附近的SEs(图2d)。这些受SE调控的TF形成了一个相互关联的调控模式,可平衡分层上皮的增殖和分化。
本研究的调节网络模型确定了一组相互连接的自动调节TFs,称为CRC,它们反过来共同调节扩展的SE网络(补充图2b)。这些CRC由不同核心TF的组合形成。
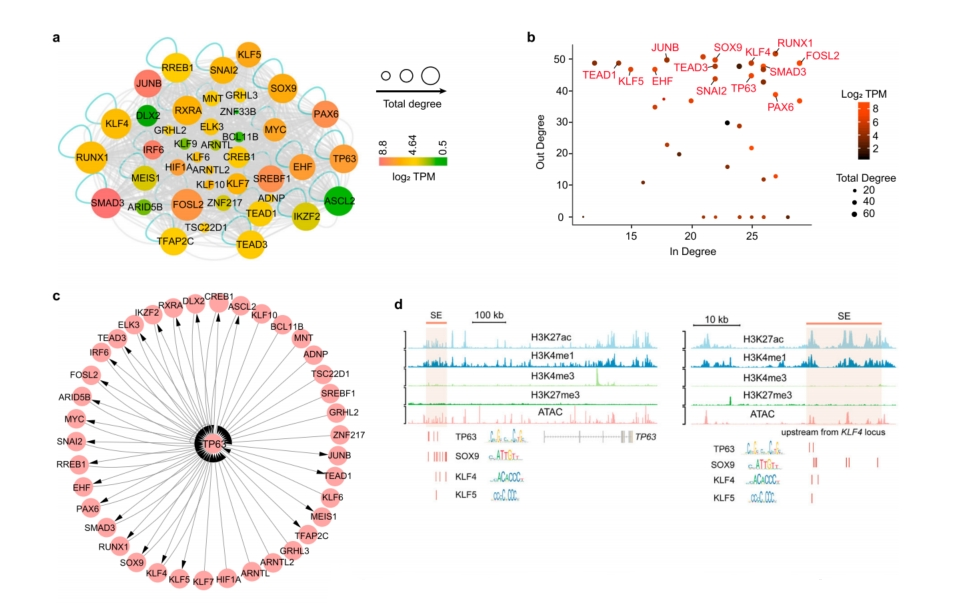
图2 CRC模型表征了LSC特异性TF网络
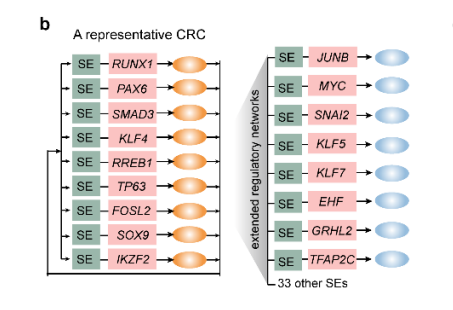
补充图2b LSCs中具有代表性的CRC
3、RPS形成一个种系特异性( lineage-specific)的CRC
为确定CRC核心TF,通过总连通性(in degree + out-degree)预测RUNX1、SMAD3和FOSL2是TF网络的“核心”(图2b)。此外,RUNX1在CRC Clique富集中表现最好,SMAD3表达水平最高(图2e和补充图2c)。因此,将重点放在RUNX1和磷酸化的SMAD3 (pSMAD3, SMAD3的激活状态)上,它们的表达模式与PAX6完全一致。
分析了内源性RPS的结合谱,发现在PAX6位点内,RPS占据了一个大的SE结构域,具有高水平的H3K27ac、H3K4me1和ATAC信号(图2h)。同样,RUNX1和SMAD3位点内的SE元件表现出RPS的共定位(图2h),说明PAX6、RUNX1和SMAD3三者有相互作用。RPS还共同调节其他TF,从而建立一个扩展的调节网络(图2i)。
RPS与SE相互作用,形成一个种系特异性的调控回路CRC。
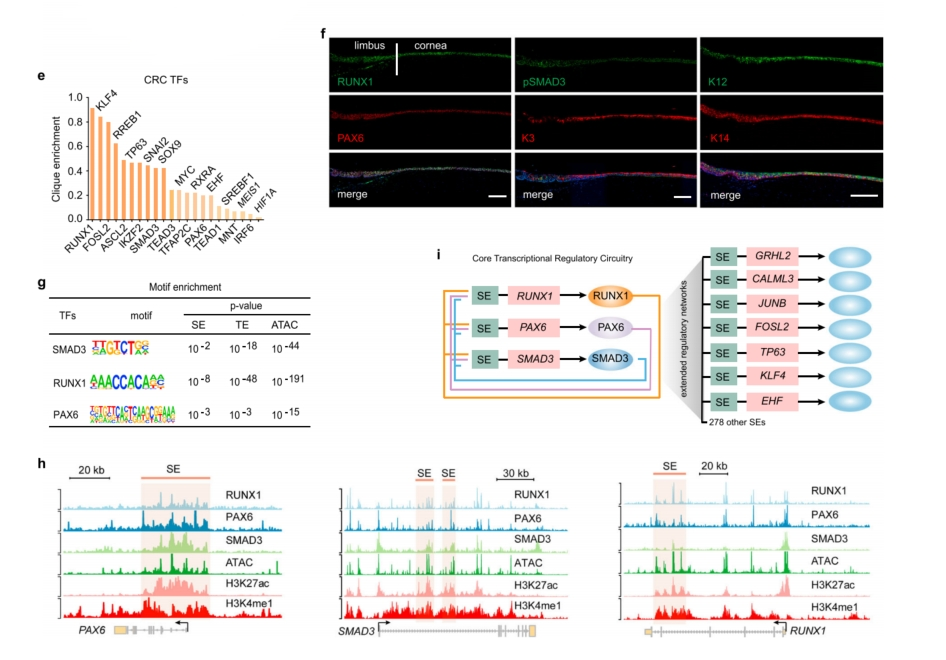
图2 CRC模型表征了LSC特异性TF网络
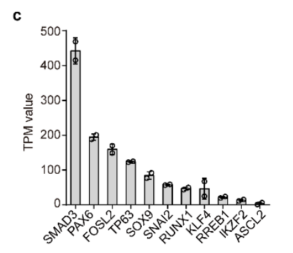
补充图2c 所选CRC TF的TPM值
4、RPS建立的CRC是LSC细胞身份决定(lineage commitment)所必需的。
之前的研究中,PAX6已被确定为角膜上皮命运决定的核心调节因子。为了研究RUNX1和SMAD3的潜在功能,使用shRNAs来敲低它们在LSCs中的表达。GO分析显示,两组中上调的基因都显示出与角化/角化和表皮发育、分化和功能显著相关(图3b);这与皮肤上皮干细胞(SESC)特异性基因谱观察到的结果相似(补充图3f)。基因集富集分析(GSEA)也表明RUNX1或SMAD3敲低后,LSC表达模式向SESC模式变化(图3c)。结果表明RUNX1和SMAD3是LSCs干细胞命运调控所必需的。
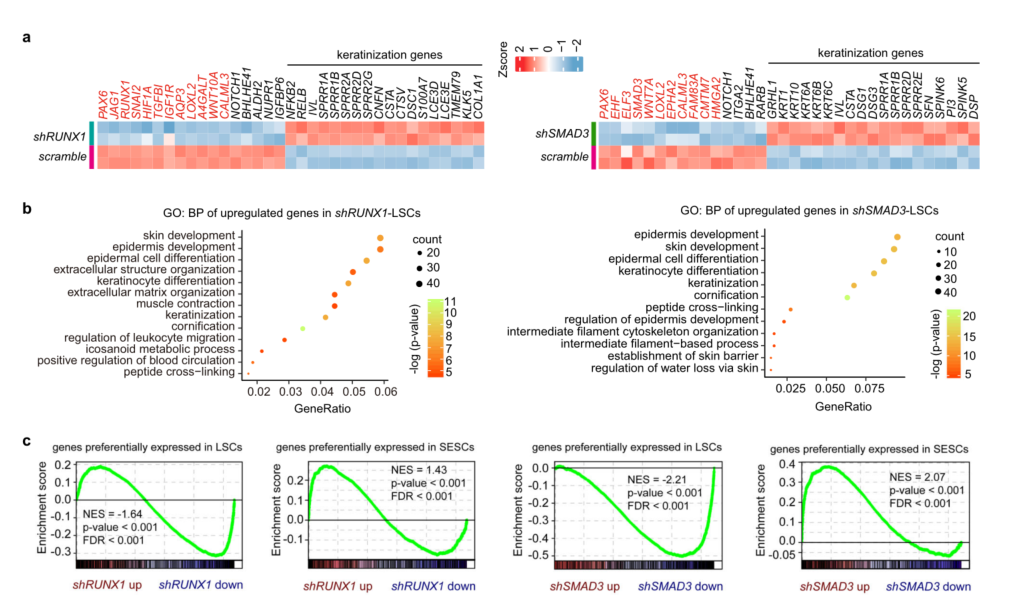
图3 RUNX1或SMAD3缺失诱导细胞身份转换
5、RPS协同调控LSC细胞身份相关基因的表达
RPS在基因组上的结合模式相似(图4a),RPS的基序在各自峰的中心共同富集(图4b),表明它们频繁的紧密结合和功能协同。此外,共免疫沉淀实验证实内源性RUNX1、PAX6和pSMAD3蛋白在LSCs中相互作用(图4c)。RPS结合位点在整个基因组中高度重叠(图4d),在SE和TE上的分布模式高度相似(图4e)。说明RPS以蛋白复合体的方式结合SE和TE,并发挥相应功能。
TF热点是由多个核心TF协同占据的功能调控元件,决定着细胞身份。发现RPS共结合热点与许多关键的角膜上皮基因相关,如CLU、ALDH3A1、NOTCH1、TP63和SFN39以及它们自身(图4g)。具体来说,RPS复合物占据了TGFBI、AQP3和IGF1R位点上的SE和TE(图4h)。此外,RPS热点相关基因丰富,用于基本的泛上皮生物学过程和信号通路(图4i)。总的来说,RPS通过协同调控CRC维持LSC干细胞身份及稳态。
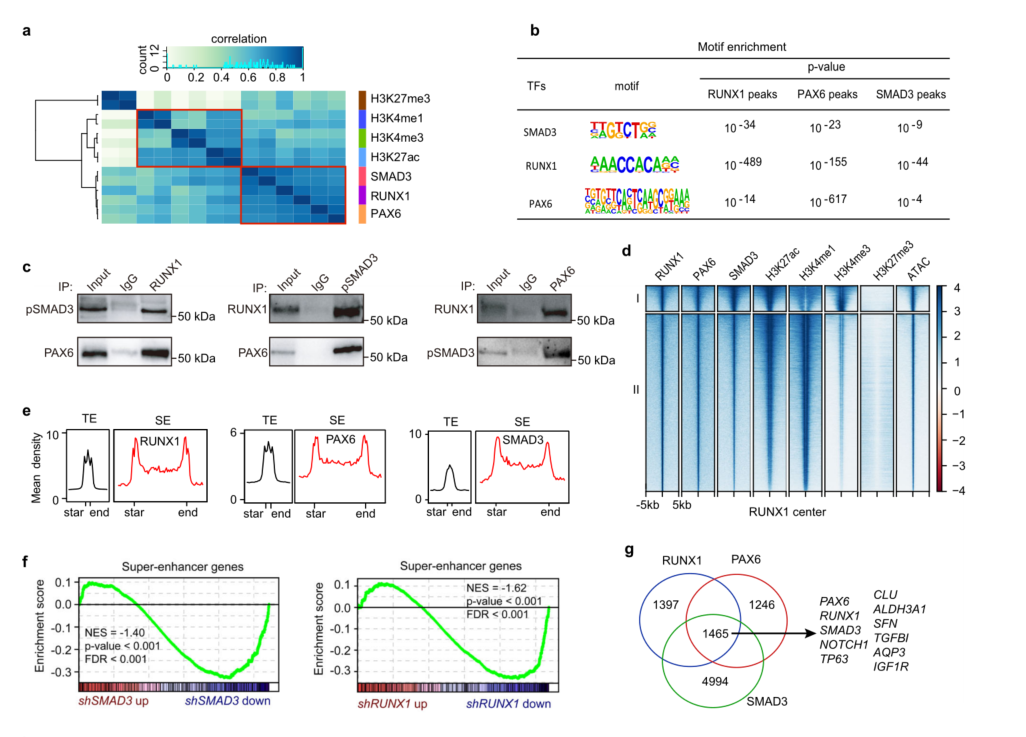
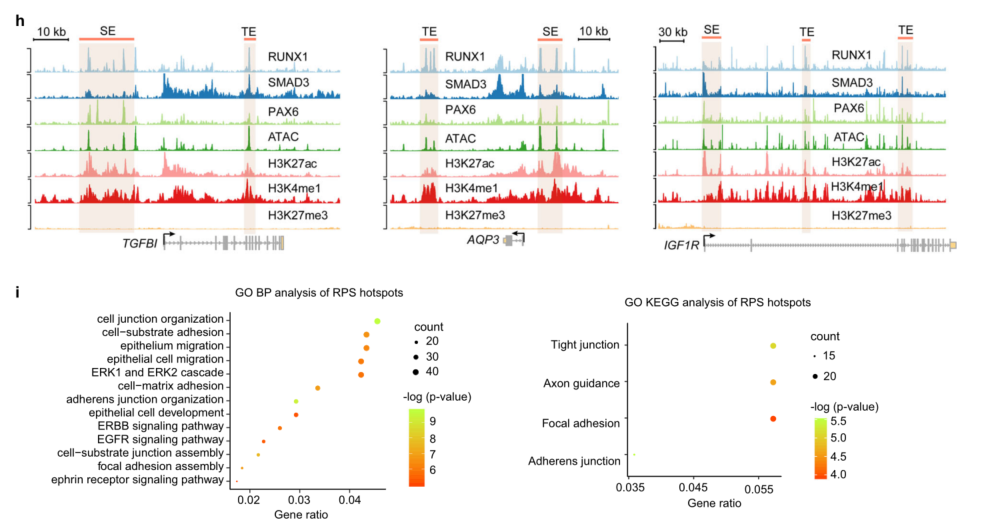
图4 RPS复合物正调控SE活性
6、RUNX1通过影响H3K27ac修饰水平,调控LSC细胞身份相关基因的表达
敲低RUNX1,H3K4me1、H3K4me3和H3K27me3的富集变化可以忽略不计(图5a),几乎全基因组范围内(98.5%)的H3K27ac富集减少(图5b)。结合RNA-seq数据,发现66%的基因转录下调(RUNX1 KD)伴随着靠近其位点的H3K27ac信号的减少(图5c),表明RUNX1通过调节H3K27ac富集激活了谱系特异性基因转录。
RUNX1 敲除导致LSCs中SE区域的全局H3K27ac信号显著降低(图5d)。大多数SE(79%)表现出H3K27ac水平的显著降低(图5e)。在runx1缺失的LSCs中,H3K27ac在两个生物重复中分别只鉴定出384个和143个SE (Supplementary Fig. 5c),远远少于野生型LSCs(638个和644个)。特别是,RUNX1缺失后,PAX6、TGFBI位点上RUNX1结合的SE结构域的H3K27ac水平显著降低,而H3K4me1和H3K27me3的富集没有明显变化(图5f)。这导致SEs转化为TEs,并伴随着其靶基因转录水平的下降(图3a)。这些数据表明,RUNX1通过影响H3K27ac修饰水平,调控LSC细胞身份相关基因的表达。
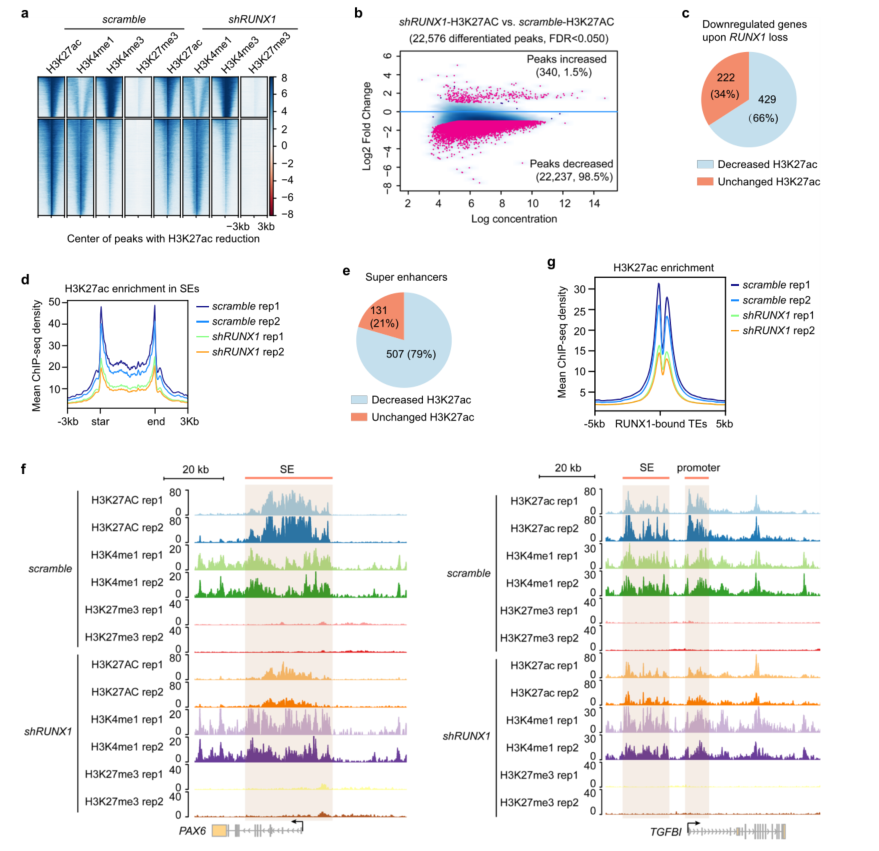
图5 RUNX1缺失会降低H3K27ac在谱系特异性增强子中的富集
三、研究结论
本研究以角膜上皮为模型组织,利用ChIP-seq、ATAC-seq绘制了角膜缘干细胞LSCs组蛋白修饰和染色质可及性图谱,构建了基于超级增强子(SE)和转录因子(TF)互作的转录调控网络。RUNX1、PAX6和SMAD3 (RPS)作为复合体,相互调控组成核心转录调节回路(CRC)。其中RUNX1通过影响组蛋白乙酰化水平调控LSC特异性基因的转录。RPS的异常会导致细胞从角膜上皮转变为表皮类型。
参考文献:
Core transcription regulatory circuitry orchestrates corneal epithelial homeostasis.[J]Nature Communications, 2021.