2023年发表于《Cellular & Molecular Biology Letters》(IF =8.3)
一、研究背景
皮肤是人体最大的器官,是人体的天然保护屏障,皮脂腺(SGs)产生的皮脂在保护和滋润皮肤系统方面起着至关重要的作用。SGs功能障碍和皮脂分泌不规则会引起各种慢性炎症疾病,如面部痤疮、特应性皮炎、脂溢症、牛皮癣和酒糟等。以往肤病学的临床和研究主要集中在下丘脑-垂体-甲状腺(HPT)轴、下丘脑-垂体-肾上腺皮质(HPA)轴和下丘脑-垂体-性腺(HPG)轴三个神经内分泌轴。由于激素和神经肽的变化,SGs功能异常在青少年痤疮中比较常见除了已知的雄激素、生长因子、催乳素、促肾上腺皮质激素和促黑素的远端调节外,希望寻找更多新的近端调节因子对SGs的直接影响。本研究从PND-35和PND-25大鼠中分离皮脂腺组织并进行转录组测序,研究了神经肽Y受体Y2 (NPY2R)基因以及细胞内和核内调控SGs的信号通路。本研究结果有利于深入了解SGs在青春期发生功能的分子机制,并为从激素调控角度治疗寻常痤疮提供一定的理论依据。
二、研究结果
1、皮脂腺在青春期开始后变得活跃
首先,获得PND-25和PND-35雌性SD大鼠掌部、乳腺乳头和腹部的皮肤组织。一般情况下,SGs主要富集于掌侧和乳腺皮肤。我们观察到,与PND-25相比,PND-35中SGs体积巨大且数量众多(图A)。此外,与PND-25相比,PND-35中KRT5(祖细胞的生物标志物)和KRT10(导管和皮脂细胞的生物标志物)的表达强劲(图B)。同样,油红O染色用于研究皮脂合成和分泌的状态。与PND-25相比,PND-35的掌侧和乳腺皮肤组织中的皮脂水平更高(图C)。上述结果表明,青春期大鼠的SGs分化和皮脂合成和分泌被大量激活。
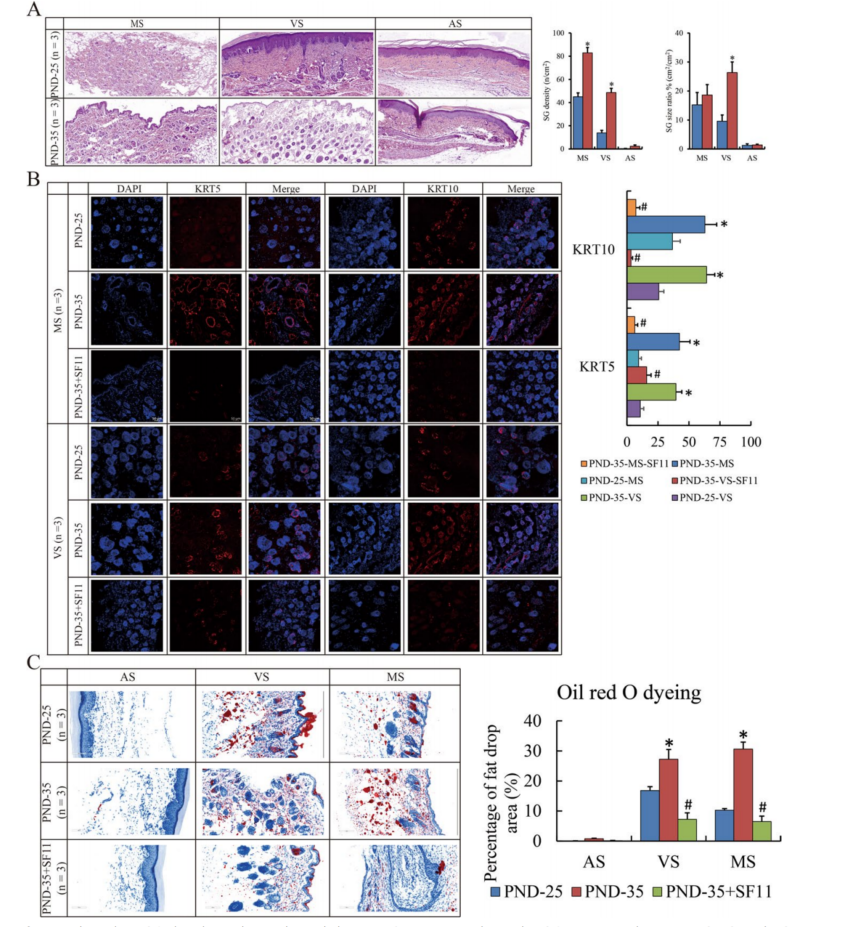
图1 丰富的SG分布于青春期皮肤
2、NPY2R与皮脂腺抑制作用有关
通过RNA测序研究皮肤组织的转录组变化,获得了PND-25和PND-35之间的差异表达基因(DEGs)(图2A)。由于主要关注SG的DEGs,我们排除了没有SGs的腹部皮肤样本,362个基因中的剩余子集(与PND-35相比,PND-25中127个基因上调,235个基因下调)被认为是SGs的假定特殊DEGs(图2B)。Metascape显示,对这362个DEGs的GO和KEGG分析显示,随着青春期的开始,激素调节、腺体发育、细胞连接和黏附以及上皮分化受到影响(图2C)。本研究观察到神经肽Y受体Y2 (NPY2R)在PND-35中显著下调(PND-25 vs PND-35: 掌侧皮肤中log2 FC = 1.62, p = 0.018;乳腺皮肤log2 FC = 1.73, p = 0.005),这意味着相应的底物NPY可能是SG功能的重要配体。与PND-25相比,在PND-35的掌侧和乳腺皮肤组织中,只有NPY受体家族中的NPY2R (NPY1R, NPY2R和NPY5R)的蛋白表达水平降低(图2D, E)。
有趣的是,NPY2R拮抗剂SF-11皮下给PND-35大鼠24小时,导致KRT5和KRT10的表达降低,并损害皮脂水平(图1B,C).所有这些数据表明NPY2R可能与皮脂合成有关。
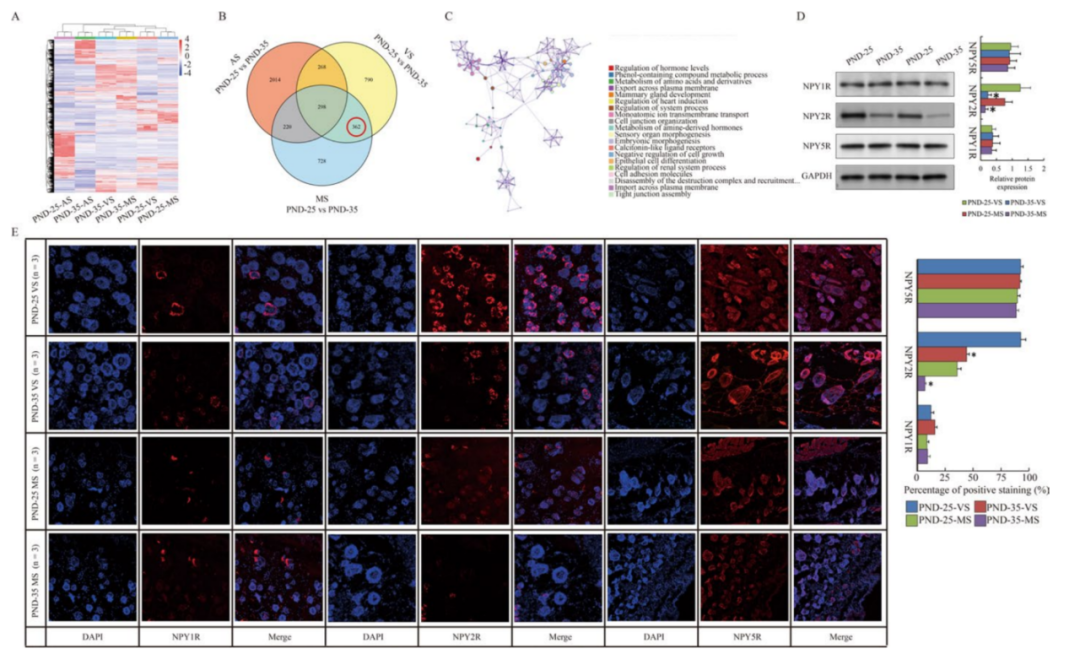
图2 青春期皮肤NPY2R下调
3、NPY2R/NPY5R异源二聚体与磷酸化的NFATc1相互作用
由于NPY受体在细胞膜上以二聚体形式存在,本研究使用凝胶过滤法研究了NPY2R与NPY1R或NPY5R的潜在异源二聚体。图3A和图3B表明,在PND-35中一个含有NPY2R/NPY5R异源二聚体的复合物由于NPY2R的降低而减少。为了弄清这一可变复合体及其背后的机制,通过抗体免疫沉淀捕获NPY5R。在图3C的140 kDa附近有一个感兴趣的条带,与PND-25相比,PND-35中的条带明显减弱,质谱鉴定其为活化T细胞核因子1 (NFATc1)(图3D)。在PND-25中p-NFATc1与NPY2R相互作用大量存在,但在PND-35中很少(图3A, B, E)。免疫荧光也显示PND-35中p-NFATc1(磷酸化的NFATc1)显著减少(图3F)。综上所述可知,在PND-25的皮脂腺细胞中,NFATc1可以与NPY2R相互作用。
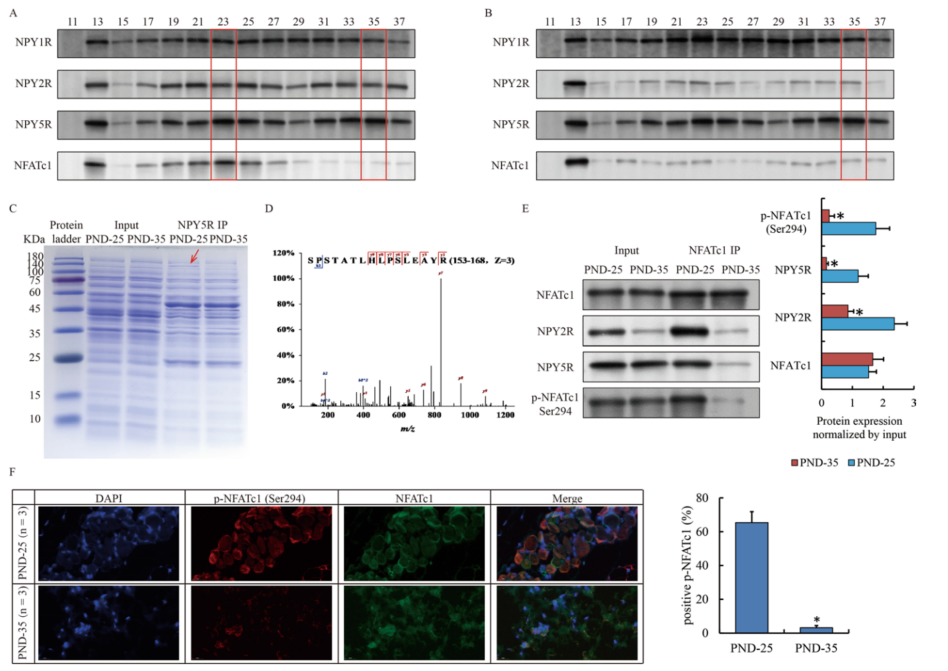
图3 青春期前SG中NPY2R/NPY5R/NFATc1的特殊蛋白复合物
4、NFATc1在全基因组范围内的结合增强了皮脂细胞的转录活性
NFATc1进入细胞核,去磷酸化后可以作为转录因子发挥作用,因此进一步研究了NFATc1在皮脂腺细胞中的全基因组范围内的结合情况。结果表明,PND-35中NFATc1在基因组中的丰度高于PND-25(图4A)。且PND-35中NFATc1在基因间区域的结合增加(图4B)。利用EnhancerAtlas数据库分析发现,与PND-25相比,PND-35有154个增强子区域与显著增加的NFATc1结合峰重叠。同时,这154个增强子中的126个在10 kb范围内包含至少3个DEGs(图4C)。IGV显示了两个典型增强子,其后是参与皮脂腺合成的基因Ucp2和Pou5f1(图4D, E)。此外,除了增强子以外的其他区域,在PND-25和PND-35之间,差异表达基因与NFATc1差异结合没有显著相关或弱相关(图4F)。以上数据表明,NFATc1与增强子的差异结合可以调控皮脂腺系统中靶基因的转录。
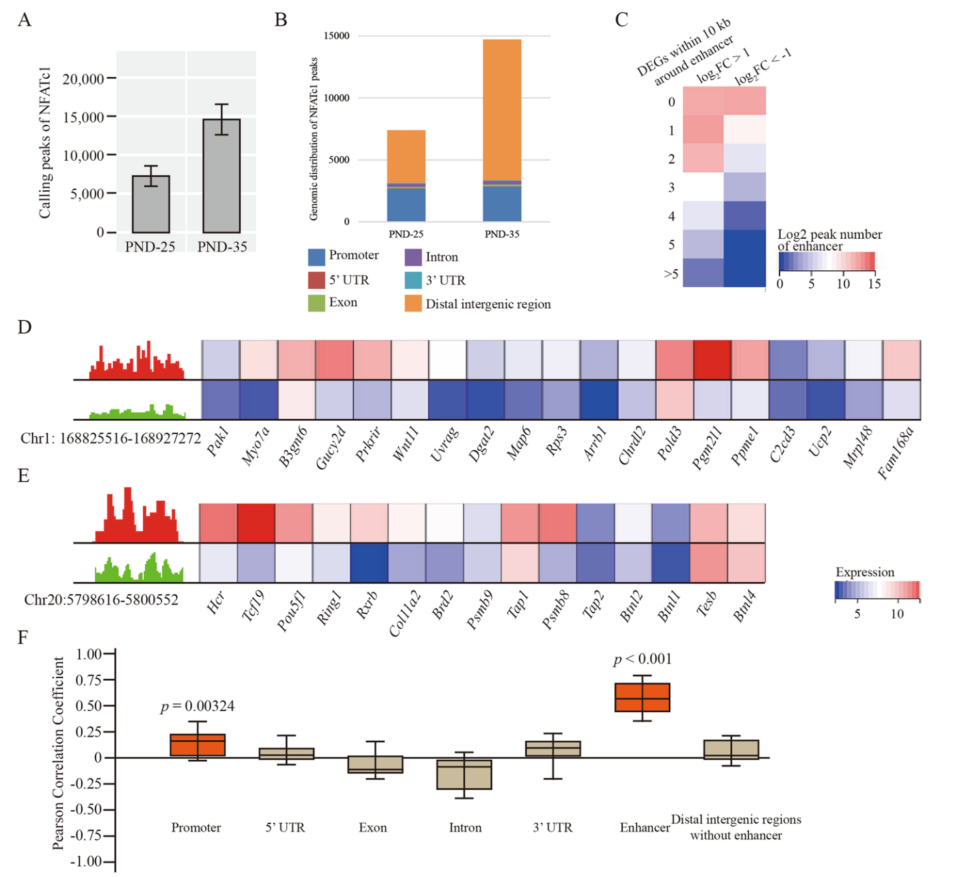
图4 掌部皮肤中NFATc1与增强子在全基因组范围内的结合情况
5、抑制DYRK1A可促进NFATc1的核转位和活性
接下来研究了PND-35皮脂腺中哪一种磷酸酶或磷酸激酶作用于NFATc1的去磷酸化。据报道,CDC2、PIM-1、mTORC1、IκB Kinaseε、MAP3K8、DYRK1A等激酶在其他组织或疾病中影响NFAT c1的磷酸化和核转位,western blot检测上述激酶的表达。从图5A可知,这些蛋白质在PND-25和PND-35之间差别不大。其中,与PND-25相比,PND-35中DYRK1A (Tyr271/319)的磷酸化显著降低,而mTOR (Ser2448)略微升高(图5A)。mTOR的激活对NFATc1的核转位有相反的作用。因此,本研究仅用DYRK1A抑制剂检测DYRK1A对PND-25的皮下掌部的作用,并观察到NFATc1的磷酸化也受到影响(图5B)。同时,NFATc1在细胞核内染色情况可知,DYRK1A抑制剂导致DYRK1A在PND-25中定位减少(图5C)。综上所述,研究结果表明DYRK1A与皮脂腺细胞中NFATc1的核转位和活性有关。
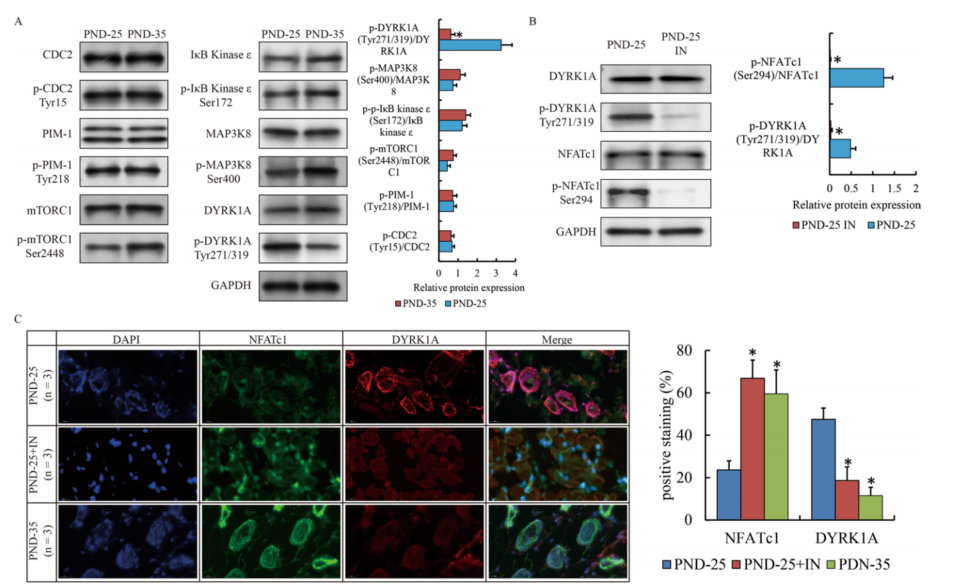
图5在青春期早期 DYRK1A诱导NFATc1的活性
三、研究结论
PND-25中DYRK1A可使NFATc1磷酸化。PND-35中,DYRK1A失活导致NFATc1去磷酸化和核定位;NFATc1去磷酸化后被激活,然后定位到细胞核中作为转录因子发挥作用。NFATc1结合在增强子区域,促进远端皮脂腺(SG)和皮脂相关基因的转录。本研究揭示了NPY2R/NFATc1/DYRK1A在青春期SG中的新作用,有助于深入了解青春期后SG功能的分子机制,并从激素调控的角度为寻常痤疮的治疗提供一定的理论依据。
参考文献:
The role of NPY2R/NFATc1/DYRK1A regulatory axis in sebaceous glands for sebum synthesis.[J]Cellular & Molecular Biology Letters, 2023.




