2022年发表于《Cell Reports》(IF =10.9)
研究简要:
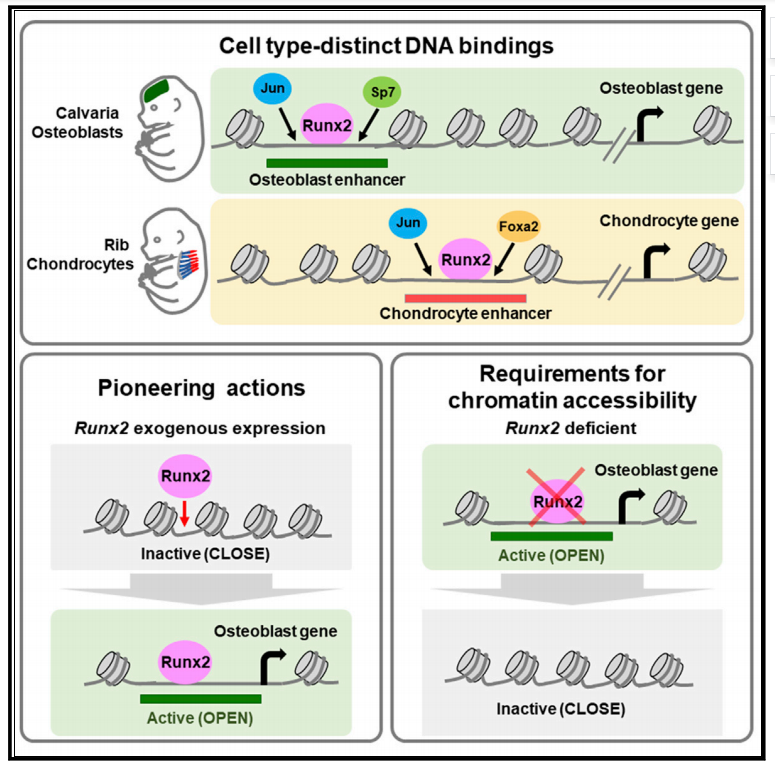
头顶造骨细胞在Jun、Runx2、Sp7的共同作用下启动造骨细胞进程;肋软骨细胞在Jun、Runx2、Foxa2的共同作用下启动软骨细胞进程。Runx2外源表达可以改变染色质可及性激活基因表达,Runx2缺失时染色质可及性减弱抑制基因表达。
一、研究背景
头顶造骨细胞在Jun、Runx2、Sp7的共同作用下启动造骨细胞进程;肋软骨细胞在Jun、Runx2、Foxa2的共同作用下启动软骨细胞进程。Runx2外源表达可以改变染色质可及性激活基因表达,Runx2缺失时染色质可及性减弱抑制基因表达。
在Runx2缺陷的突变小鼠中,成骨细胞分化被阻滞。然而,在sp7缺陷小鼠中存在Runx2阳性的成骨细胞前体,但不能分化为成熟的成骨细胞。这些数据表明,在成骨细胞发育的调控层级中,Runx2在Sp7上游启动成骨。在软骨细胞进程中,Runx2在增殖性软骨细胞中表达较弱,但随着软骨细胞退出细胞周期,Runx2表达明显上调,形成前肥大和肥大软骨细胞。Runx2在柱状软骨细胞中的异位表达加速了软骨细胞肥大,而去除Runx2活性会导致正常肥大软骨矿化的丧失。在Runx2无效突变的软骨细胞中,软骨细胞可以发生正常的肥大和矿化,但对邻近的骨膜骨程序没有影响,这表明Runx2在调节软骨和骨发育方面具有自主和独立的细胞作用。
越来越多的证据还表明,谱系特异性转录调控因子可能与Runx2协同作用。本文研究了Runx2在离体软骨及骨骼发育过程中与染色质可及性的相互关系。结合对相关增强因子的功能研究,为哺乳动物骨骼发育的调控机制提供了一定的理论基础。
二、研究结果
1、骨骼发育中不同细胞类型开放染色质特征的鉴定
在新生小鼠P1期利用荧光激活细胞分选(FACS)纯化Col2a1-ECFP阳性肋骨软骨细胞(C2-Cho)、Col10a1-mCherry阳性肋骨肥大软骨细胞(C10-Cho)和Sp7-EGFP阳性颅骨成骨细胞(S7-Ob),使用ATAC-seq和RNA-seq研究其染色质可及性和转录谱。
主成分分析(PCA)揭示了这些细胞类型中不同的转录组和染色质可及性特征(图1A)。Col10a1和Col1a1分别编码增生性软骨细胞和成骨细胞分泌的关键胶原基质蛋白。C10-Cho染色质谱和S7-Ob染色质谱分别检测了Col10a1和Col1a1侧翼区域的(细胞类型特异性)染色质可及性(图1B)。相反,在C2-Cho和C10-Cho软骨细胞中,两者之间染色质可及区域的位置不同(图1B,上半图),表明早期柱状软骨细胞和晚期软骨细胞之间的调控差异,后者启动了肥大软骨细胞的发育。图1C显示了每种骨骼细胞类型的不同特征,与发育中的成骨细胞(即S7Ob)相比,柱状软骨细胞(即C2-Cho)和增生性软骨细胞(即C10-Cho)之间的更相似。对远端ATAC-seq峰信号进行两两比较显示各细胞类型不同的峰(C2-Cho,C10-Cho和S7-Ob)和配对组共享的峰(图1D)。GO分析C10-Cho特异性峰和C2C10共享峰与软骨发育项相关,而S7特异性峰与骨骼发育和骨化相关(图1E)。为了研究已确定的可达区域与骨骼发育中主要转录调控因子之间的关系,绘制了Runx、Sox9和Sp7的motif(图1F)。
这些结果预测了骨骼发育中主调控因子对假定的不同细胞类型的增强子区域的作用。Runx motif在肥大软骨细胞和成骨细胞可及区域的富集强化了Runx因子在不同细胞类型中的调节作用。
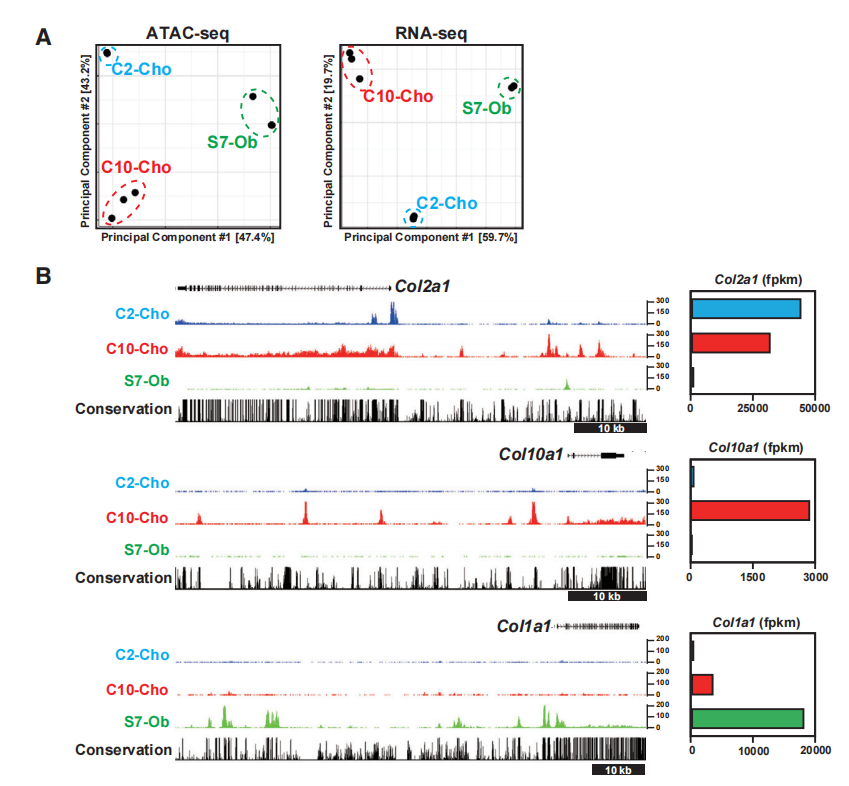
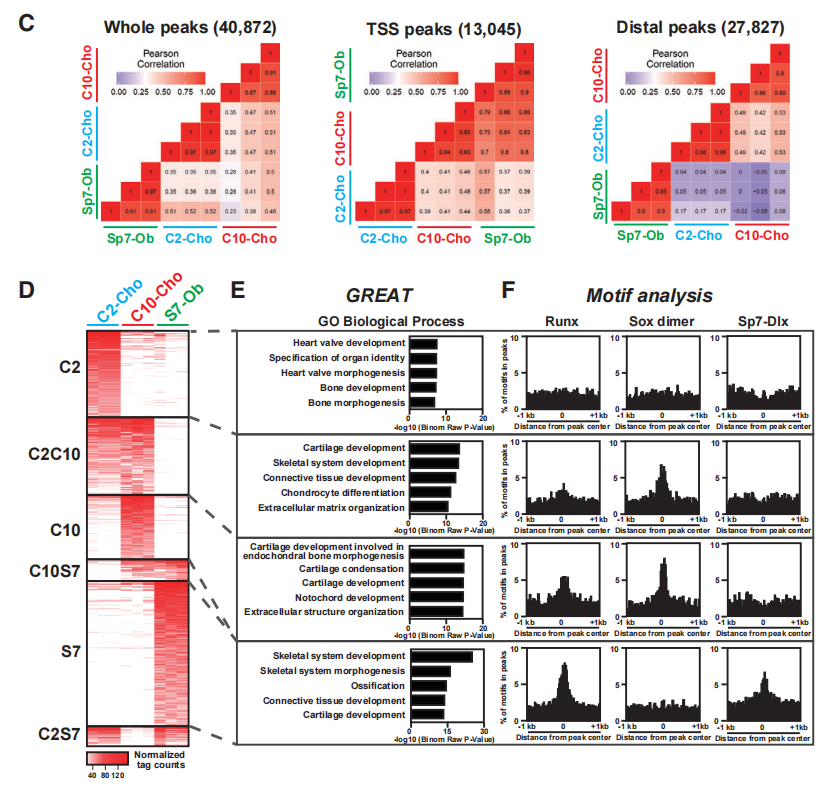
图1 新生儿软骨细胞和成骨细胞中不同细胞类型染色质可及性的鉴定
2、成骨细胞和软骨细胞中的Runx2-DNA基因组分析
为了确定Runx2与可及性区域的关系,对Runx2-DNA进行了全基因组分析。使用基因靶向策略生成Runx2-Biotin-3xFLAG敲入小鼠系(Runx2-BioFL小鼠,图2),可而实现Runx2和相关DNA靶标或结合靶标的生化分离(图2A-2C)。Western blotting检测到Runx2-BioFL蛋白水平与野生型相似(图2D),胫骨切片的免疫组织化学也显示出相同的时空分布(图2E)。在P1分析时,Runx2-BioFL等位基因纯合子的小鼠没有明显的表型,可以生育,并且骨骼发育正常(图2F和2G)。
为了比较Runx2在成骨细胞和软骨细胞中的相互作用,对新生Runx2- BioFL小鼠的颅骨成骨细胞和肋骨软骨细胞进行了ChIP-seq分析。鉴定出成骨细胞中的10241个Runx2-BioFL ChIP-seq峰和软骨细胞中的15390个峰(图2H)。发现远端Runx2峰与成骨细胞或软骨细胞相关的基因高度相关,而TSS Runx2峰更多地与一般细胞活性相关(图2I)。因此,Runx2与其保守motif的结合可能是Runx2与DNA相互作用的主要作用方式。
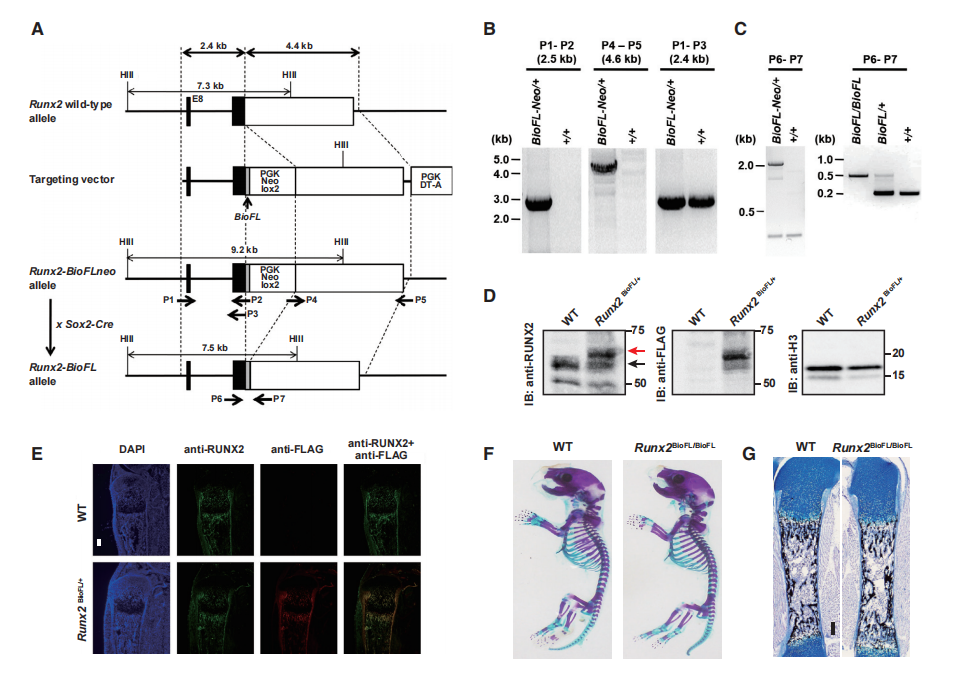
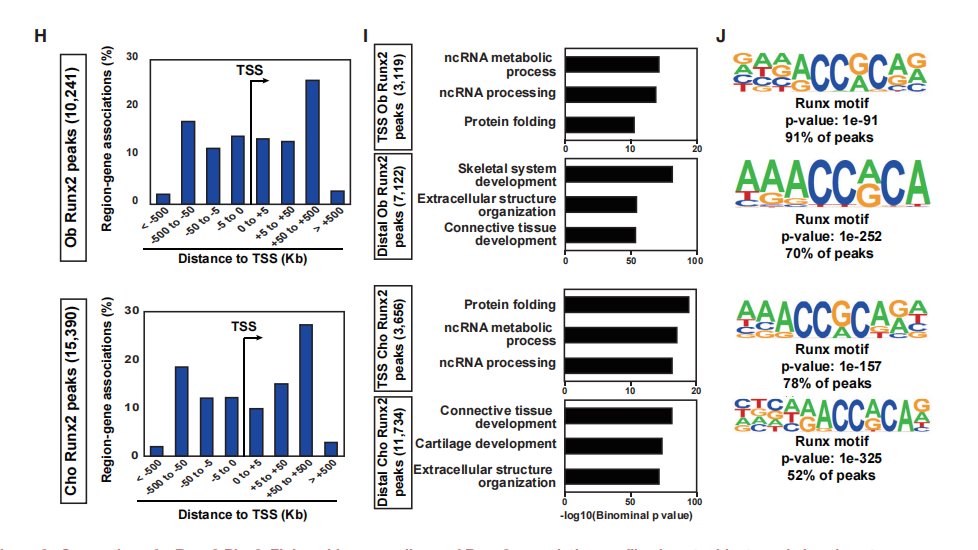
图2 Runx2 Bio-3xFL敲入小鼠系的建立和Runx2在成骨细胞和软骨细胞中的关联谱
3、Runx2的作用及其与其他转录调控因子的潜在相互作用
图3A显示了Obs和Chos中染色质可及性和Runx2-DNA结合的信号强度。GO分析可知成骨细胞和软骨细胞不同区域分别在骨骼发育和软骨相关基因集中富集(图3B)。为了预测可能在成骨细胞和软骨细胞中与Runx2相互作用的转录调节因子,对峰集进行了从头基序分析(图3C)。bHLH motif在成骨细胞特异性区域富集,表明调节因子与Runx2一起作用于调节细胞类型特异性基因表达的增强子。
为了缩小与Runx2作用于细胞类型特异性增强子的候选转录因子的范围,研究比较了C2-Cho、C10Cho和S7-Ob中相关的转录因子的表达(图3D)。为了研究Runx2与染色质可及区域中选定的转录调控因子之间的关系,将ChIP-seq数据与Runx2- DNA结合和染色质可及性谱相结合,基于文献报道的基序富集、基因表达和生物学功能,Jun被确定为软骨细胞和成骨细胞中Runx2的潜在共调节因子,Foxa2是软骨细胞特异性的共调节因子,Sp7是成骨细胞特异性的共调节因子。
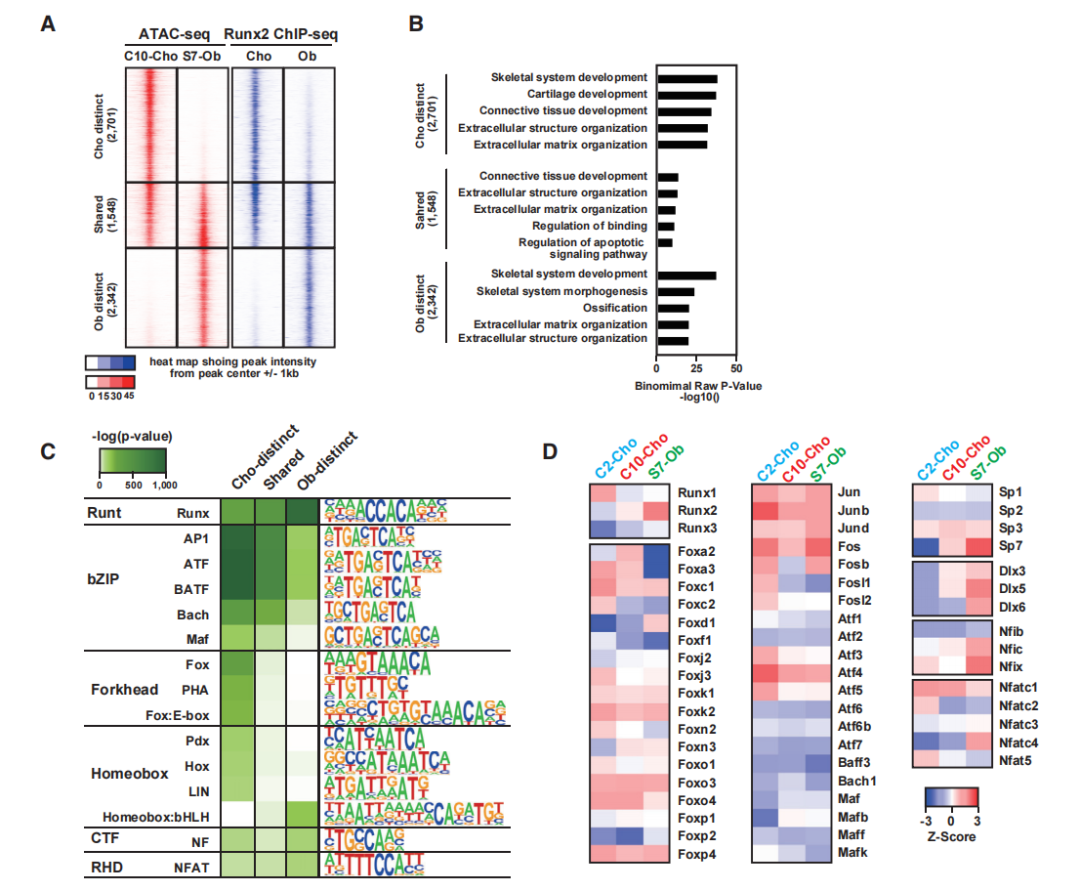
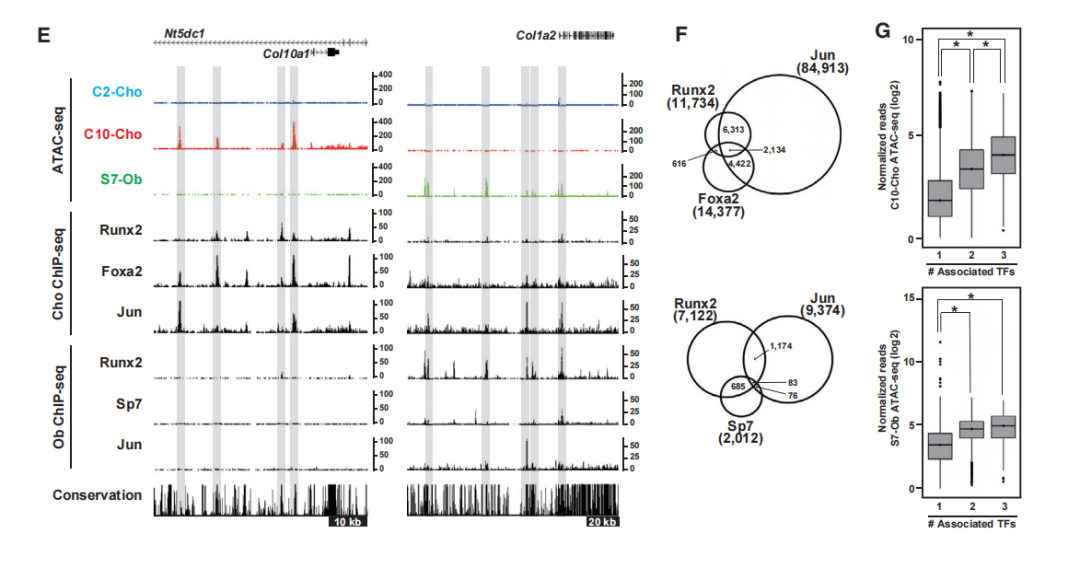
图3 Runx2的作用及其与基因组上其他转录调控因子的潜在相互作用
4、Runx2对成骨细胞染色质可及性的影响
为了确定Runx2是否影响细胞特异性的染色质可及性,生成了Sp7EGFP:Cre;Runx2fl/fl;R26RtdTomato复合突变小鼠,并研究Runx2敲除对突变型成骨细胞的影响。PCA显示Runx2 cHomo KO细胞的染色质可及性模式与野生型和Runx2 cHet KO细胞明显不同(图4D)。Runx2 cHomo KO细胞与Runx2 cHet KO细胞相比,有3311个可访问区域发生了显著变化。敲除Runx2后,669个区域的染色质可及性增加,2643个区域的染色质可及性降低(图4F和4G)。大多数差异可及的区域位于远端区域,潜在的增强子,而不是在TSS(图4F)。敲除Runx2后可及性降低的区域与骨骼发育和骨化相关基因高度相关(图4H)。敲除Runx2后,AP-1、NF和NFAT的基序在可及性增加的区域富集,而Runx、Sp7-Dlx和AP-1基序在染色质可及性缺失的区域高度富集(图4I)。这些结果表明,几个成骨相关基因染色质可及性的变化与Runx2的直接结合相关,Runx2与其他转录因子(包括Sp7和AP-1)也有潜在相互作用。
为了研究Runx2及其候选共同调控因子的参与,在差异可及区域中绘制了Sp7、AP-1和Runx2的ChIP-seq信号。Runx2和Sp7与需要Runx2的区域高度相关,而Jun与Runx2与染色质可及性抑制相关的区域相关(图4J)。转录分析显示,Runx2敲除后,Sp7和Dlx家族成员的表达减少,AP-1家族成员的表达增加(图4K)。
研究假设与Runx2作用的共调节因子的结合可以解释Runx2敲除后染色质可及性谱的改变。敲除Runx2后,对Runx2、AP-1和Sp7相交峰区的可及性的研究,发现通过增加Jun表达来维持Runx2敲除后染色质可及性的代偿机制。成骨细胞中的染色质可及性可能是通过Runx2及其潜在的共调控因子(包括Sp7和AP-1)对调节成骨细胞发育的增强子模块的协同作用来维持的。
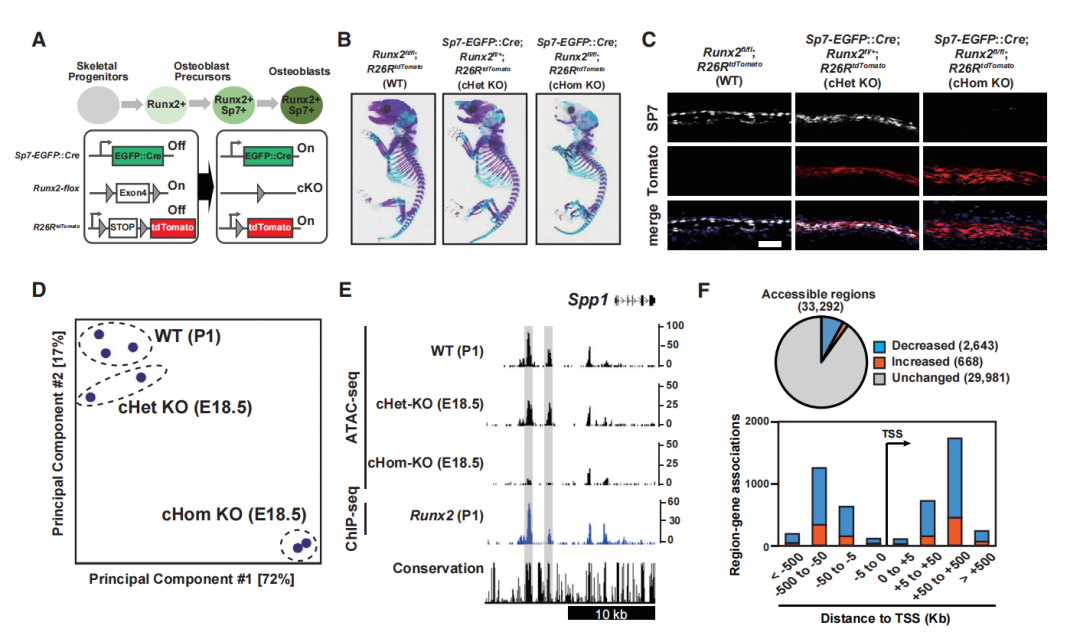
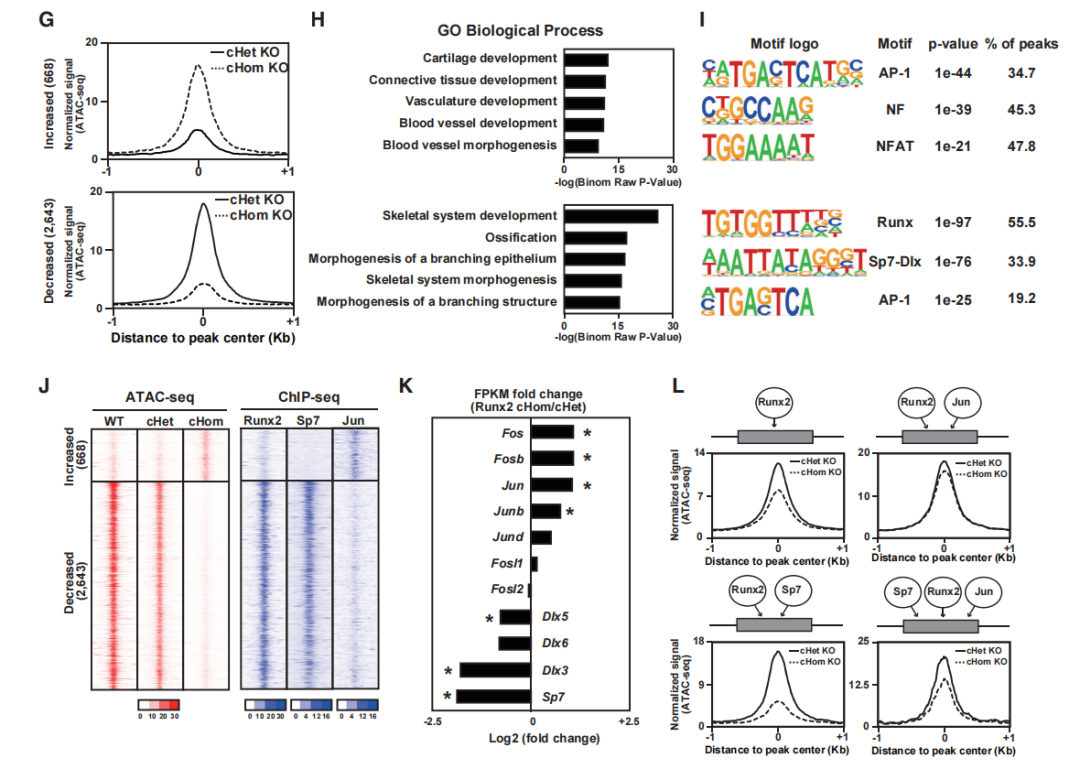
图4 Runx2敲除对Ob染色质可及性的影响
5、Runx2对染色质可及性的开创性作用
为了确定Runx2是否具有先锋因子(促进封闭染色质位点开放)特性,在骨形态发生蛋白2 (BMP2)存在的情况下,在NIH3T3成纤维细胞中过表达Runx2-BioFL,产生成骨细胞样细胞。Runx2-BioFL转导两天后,在加入BMP2并诱导成骨后第0天和第3天分别进行ATAC-seq和Runx2-FL ChIP-seq(图5A)。碱性磷酸酶(ALP)染色证实Runx2/ BMP依赖性成骨细胞分化(图5B)。第0天就观察到Runx2与这些区域的结合,但呈封闭的染色质构象。在第3天,这些区域表现出增强的染色质可及性(图5C和5D)。因此,Runx2在第3天的结合增强,说明了Runx2可能通过与其他因子的相互作用使得染色质的可及性增强。

图5 Runx2功能增益对成纤维细胞染色质可及性获得的影响
6、Runx2靶向功能性成骨细胞增强子的鉴定
为了验证Runx2是否结合增强子区域,进行了CROP-seq分析,为9种可能的增强子设计了sgRNAs作为Runx2靶点。Runx2基因的sgRNAs作为阳性对照,非靶向序列的sgRNAs作为阴性对照。分析了来自5136个细胞的单细胞RNA-seq (scRNA-seq)数据,在携带Runx2 sgRNA的细胞中,47个基因的表达显著降低,包括已知的Runx2靶点Bglap、Ibsp和Spp1(图6A)。将其定义为Runx2依赖基因,47个基因与骨化和骨骼发育高度相关(图6B)。在表达sgRNA的Sp7增强子-1细胞中,Runx2依赖性基因的表达显著降低(图6C和6D),而管家基因Actb和Gapdh的表达没有显著改变(图6D),这表明Sp7增强子-1作为功能性增强子,介导了Runx2参与调控的sp7诱导成骨细胞分化。Sp7增强子-1在成骨细胞中表现出Runx2结合和Runx2依赖的染色质可及性(图6E和6F)。
为了验证Runx2对Sp7增强子-1的影响,克隆了含有Sp7增强子-1 (Sp7EnhOb,图6F)。检测Runx2表达对增强子驱动的荧光素酶活性的影响。结果表明Runx2直接结合远端Sp7增强子并调节Sp7转录。
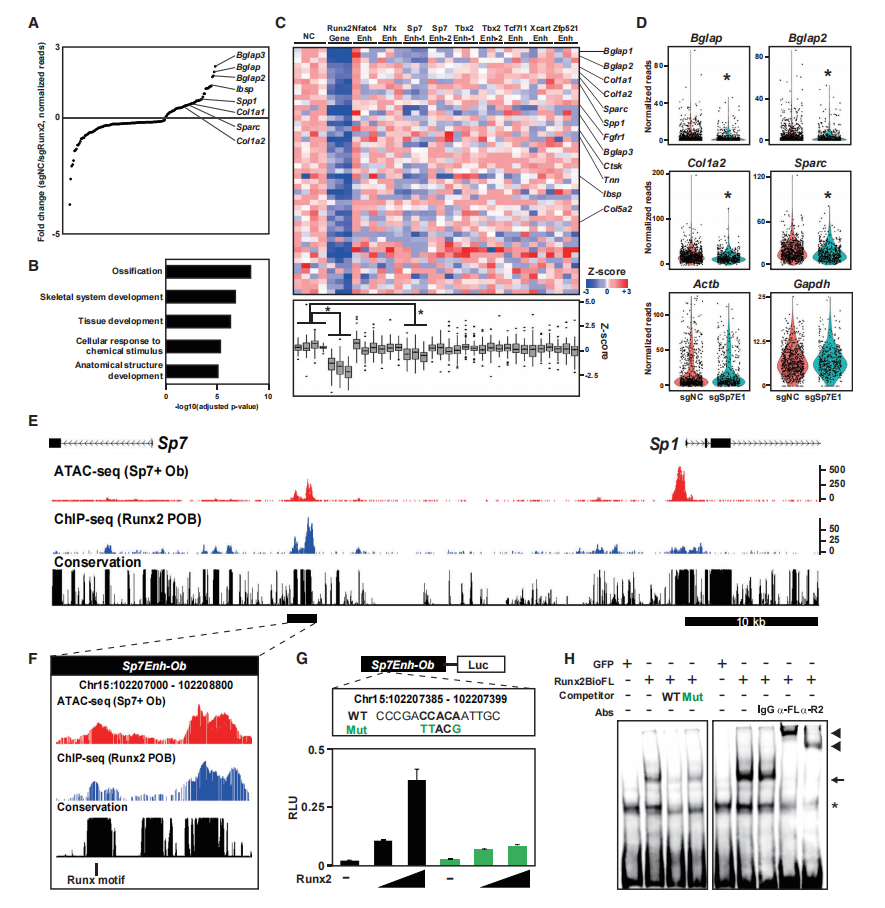
图6 Obs中Runx2靶向增强子的筛选
7、体内Sp7增强子活性的验证
为了研究Sp7Enh-Ob在体内的活性,构建了表达lacZ-GFP融合盒的转基因报告小鼠系。染色结果显示发育中的骨组织特有的报告活性(图7A)。免疫组织化学显示,报告活性仅限于颅骨和长骨中sp7阳性成骨细胞的部分(图7B)。虽然内源性SP7在长骨的成骨细胞和前肥大软骨细胞中表达,但增强子驱动的报告活性仅在成骨细胞中检测到(图7B)。
为了研究Sp7Eh-Ob对骨骼发育的作用,构建了Sp7Eh-Ob的KO (Sp7EnhOb-/-)。一系列试实验结果表明,远端Sp7增强子对于Sp7(位于Runx2的下游)的正常成骨细胞特异性激活和Sp7驱动的成骨细胞分化至关重要。

图7 体内Sp7增强子活性及其对骨骼发育的作用
三、研究结论
新生成骨细胞和软骨细胞的染色质可及性是不同的,Runx2-DNA结合与不同的染色质可及性高度相关。Runx2可能通过与其他因子的相互作用使得染色质的可及性增强,例如BMP2通过转录后调控增强Runx2的表达和活性。Runx2直接结合远端Sp7增强子并调节Sp7转录;远端Sp7增强子对于Sp7(位于Runx2的下游)的正常成骨细胞特异性激活和Sp7驱动的成骨细胞分化至关重要。
参考文献:
Runx2 regulates chromatin accessibility to direct the osteoblast program at neonatal stages.[J]Cell Reports, 2022.
...................................................................................................................................................................................................













