2022年发表于《Cell Reports》(IF =10.9)
研究框架
 一、研究背景
一、研究背景
系统性红斑狼疮(Systemic lupus erythematosus, SLE)是一种复杂的系统性自身免疫性疾病,会导致多种组织中自身反应性B细胞和T细胞免疫应答激活。已有研究结果表明,T细胞的表观遗传修饰参与了SLE的发病机制。了解CD4+ T细胞中整体染色质可及性,并将可及性的差异与SLE疾病活动联系起来,可以加深对SLE发病机制的理解。
调节性CD4+ T (Treg)细胞是CD4+ T细胞的一个亚群,已知其在维持免疫耐受中起作用,并且对免疫系统稳态至关重要。单细胞分析技术可以用来鉴定和调查病理状态下的Treg细胞。据报道,I型IFNs是SLE患者的血液转录特征。数项研究表明,过量的I型IFNs可诱导Treg失调,且在不同严重程度的SLE患者中含量不同;其他研究报道了IFN介导的对炎症条件下Treg扩增或功能的积极作用。由此可知,在自身免疫性疾病的研究中,I型IFNs对Treg的影响仍然存在很大争议。
二、研究结果
1、健康对照和SLE患者CD4+ T细胞的染色质可及性图谱
63例SLE患者的65个样本和25例健康对照的37个样本(图1A)。当SLE患者的样本数量达到60份时,可达到的峰值数量接近饱和,这表明队列的样本量足够大(图1B)。构建了健康人和SLE患者原代CD4+ T细胞的全基因组染色质可及性图谱。

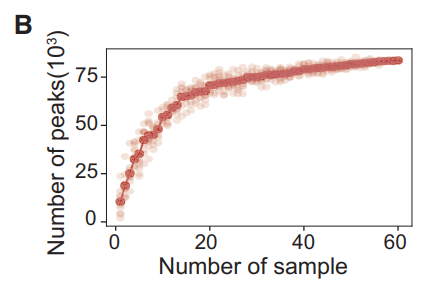
图1 SLE外周血CD4+ T细胞DNA可及性异质性的研究
2、SLE CD4+ T细胞的染色质可及性特征
主成分分析(PCA)健康的对照样本紧密聚在一起,而SLE患者样本分布更广泛(图1C),患者样本被聚类为三个不同的组(图1D和1E)。由于检测到这三组与各自的患者疾病活动度(DA)评分存在强相关性(图1F),因此将这些患者组定义为DAlow、DAint和DAhi。
DAint SLE患者表现为中度疾病活动度,DAlow SLE患者表现为轻度疾病活动度(图1F)。结果表明,根据外周血CD4+ T细胞染色质可及性的差异将患者分为三组与SLE的临床严重程度密切相关。
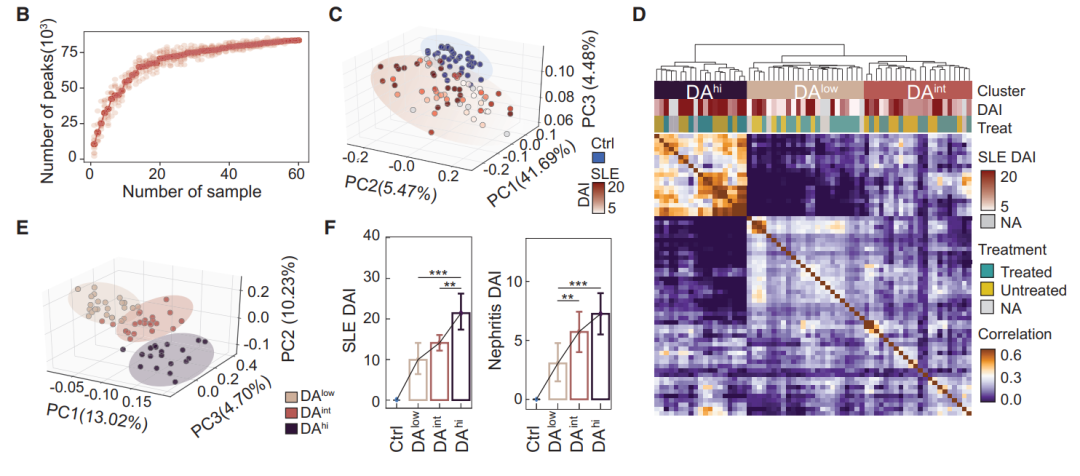
图1 SLE外周血CD4+ T细胞DNA可及性异质性的研究
分层聚类将这些峰分为五个不同的调控元件簇(图2A)。簇II的峰的染色质可及性与SLE DA显著正相关(p = 0.00017, 图2 B)。簇II的潜在生物学功能研究发现,调节SLE组织损伤的许多基因,包括STAT1、STAT4和IFNA,以及Th17细胞的标志性基因(已知Th17细胞是SLE的主要促发因素),如IL17F、RORA和IL6R,与簇II峰相关(图2A)。与上述基因相关的簇II峰在DAhi重度SLE患者中比在DAint和DAlow患者中具有更高的染色质可及性(图2C、2D)。与簇II峰相关的基因在与“炎症”(p < 10-5)和“IFN反应”(p < 10-2)相关的预测功能上具有强富集(图2E)。这些结果表明,簇II峰代表了与原发性CD4+ T细胞异常炎症和免疫反应相关的SLE疾病染色质特征。簇II峰可及性增高,可诱导Th17细胞、Treg细胞等CD4+ T细胞亚型功能障碍,促进SLE病情加重。
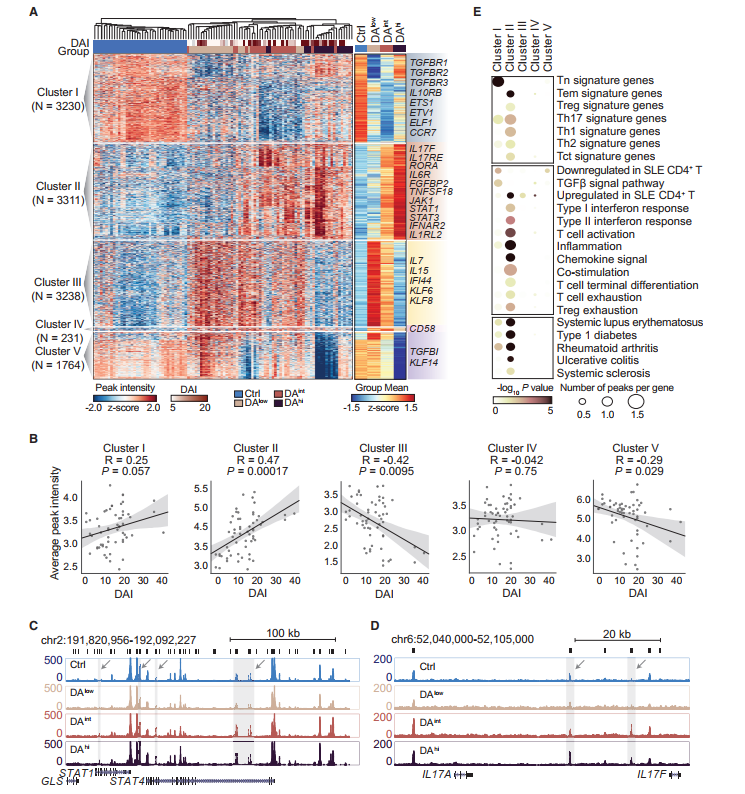
图2 不同组SLE患者的表观遗传特征
3、重症SLE患者CD4+ T细胞单细胞图谱
CD4+ T细胞是异质的,包括多种亚型,特定的CD4+ T细胞亚型可能参与SLE发病机制(图2A和2B),对原发CD4+ T细胞进行scRNA-seq分析。鉴定出16个CD4+ T细胞亚型簇(图3A和3B),并确定每个细胞簇中的细胞类型(图3C),鉴定出7种主要的细胞亚型,分别是CCR7+ Tn、CXCR5+ T、TBX21+ Th1、GATA3+ Th2、RORC+ Th17、FOXP3+ Treg和GNLY+ Tct细胞(图3D)。SLE患者中CCR7+ Tn和CXCR5+ T细胞的比例下降,Treg细胞和细胞毒性CD4+ T细胞(Tct)在内的多种Teff细胞亚型的比例增加(图3F);其中Treg细胞明显增加(p < 0.05)(图3G)。同时流式细胞术测量也有类似结果,CCR7+ Tn细胞在SLE患者中的比例显著下降(2.44倍,p = 0.0001),Treg细胞的比例显著增加(1.82倍,p = 0.005)和Tct细胞的比例显著增加(1.76倍,p = 0.02)(图3H)。
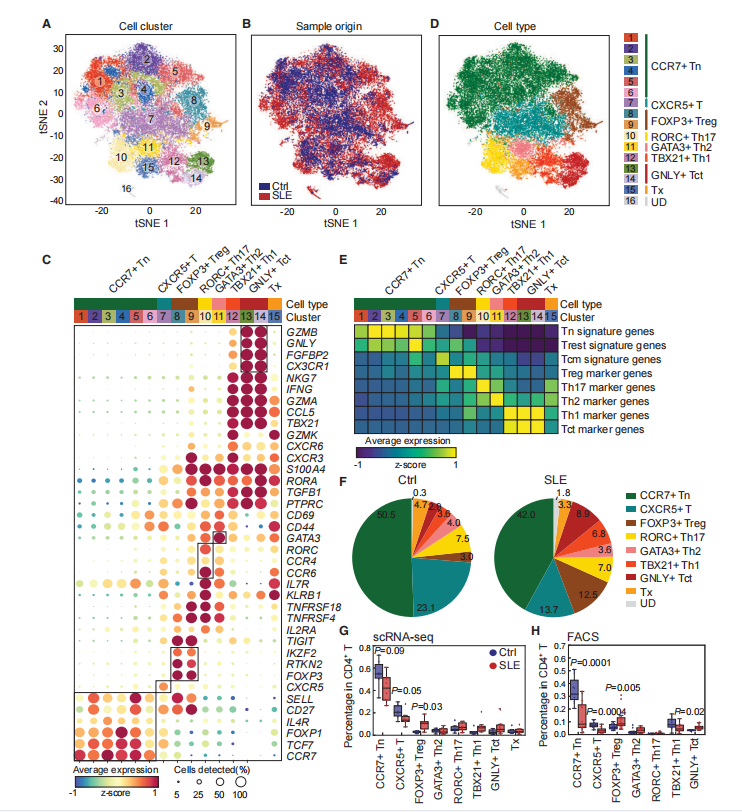
图3 正常对照和SLE患者外周血CD4+ T细胞单细胞图谱
4、重症SLE患者CD4+ T细胞亚型单细胞转录组的不同变化
为了探索每种CD4+ T细胞亚型在疾病状态下的功能差异,对SLE患者的CD4+ T细胞亚型与健康对照的相应细胞亚型进行了两两比较,共鉴定出1331个差异表达基因(DEGs)(图4A和4B)。SLE患者与健康对照之间Treg细胞的基因表达差异最大(图4D)。这些结果表明,Treg、Tct、Th17和Th2细胞主导了严重期SLE患者CD4+ T细胞的转录组变化。很多的T细胞衰竭相关基因,如TIGIT、PDCD1和LAG3在SLE Treg细胞中显著上调(图4A、4E)。qPCR和流式细胞术分析,发现每个基因在患者中的表达水平明显更高(图4F)。SLE Treg中Treg衰竭样特性的特征评分高于正常Treg(图4G)。Treg细胞的染色质可及性分析也表明,SLE患者比健康对照组更容易获得这些位点(图4H-4J)。Treg细胞的抑制活性低于健康对照(图4K)。总之,这些结果表明SLE Treg细胞可能经历功能衰竭,从而无法抑制过度反应的免疫系统。
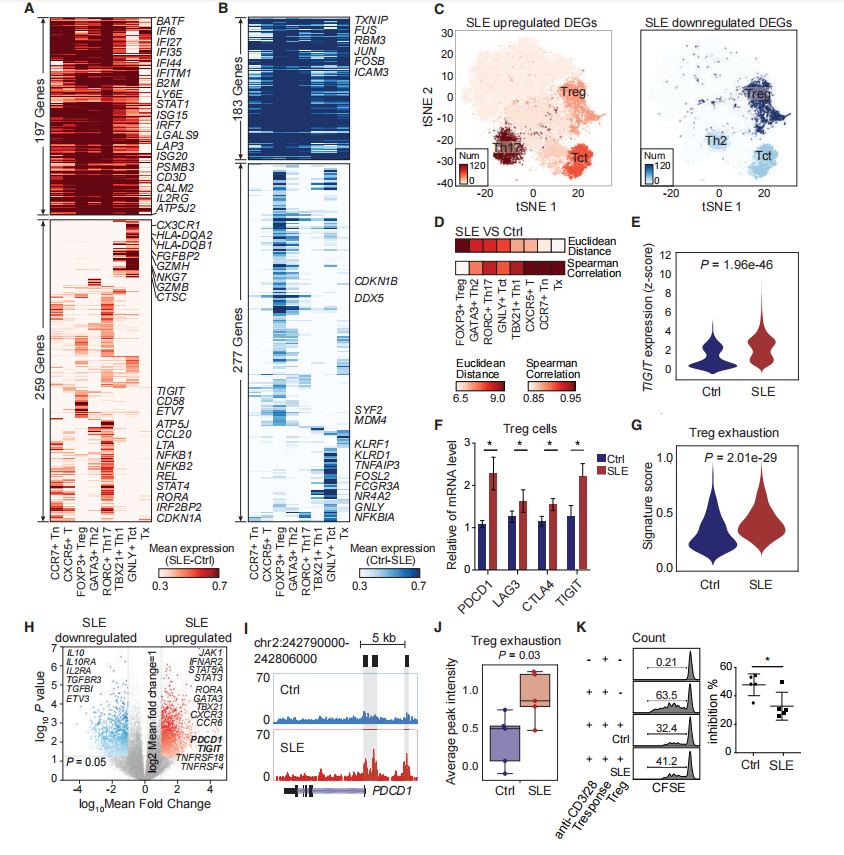
图4 正常和SLE CD4+ T亚型的组成和功能差异
5、来自SLE患者的Treg细胞功能衰竭
本研究鉴定出两个Treg细胞亚群,Treg1和Treg2(图5A)。通过拟时序分析研究了Treg1和Treg2细胞的特定轨迹,发现Treg2轨迹富集的细胞强烈表达与T细胞衰竭和Treg细胞衰竭相关的基因(图5B),Treg1和Treg2差异显著基因中的CCR7和CD74,可以用来区分两个Treg亚群(图5C-5E)。流式细胞术分析显示,严重SLE患者中Treg1 (CCR7hi CD74low)和Treg2 (CCR7low CD74hi)细胞的比例显著高于健康对照组(图5F,p <0.05)。
健康对照组和SLE患者之间Treg1和Treg2细胞的差异分别为830和818(图6A和6B)。SLE Treg2细胞高度表达T细胞衰竭的特征基因,如PDCD1和LAG3(图6C)。这些结果表明,CCR7low CD74hi Treg2细胞是SLE患者有效的Treg亚群,可能会经历功能衰竭,从而削弱其免疫抑制功能。检测的IFN-γ、IL-2和TNFα的差异结果(图6E),衰竭相关转录因子(Tcf1和Tox)的表达水平(图6F)为SLE患者中CCR7low CD74hi Treg2细胞的功能衰竭特性提供了支持。
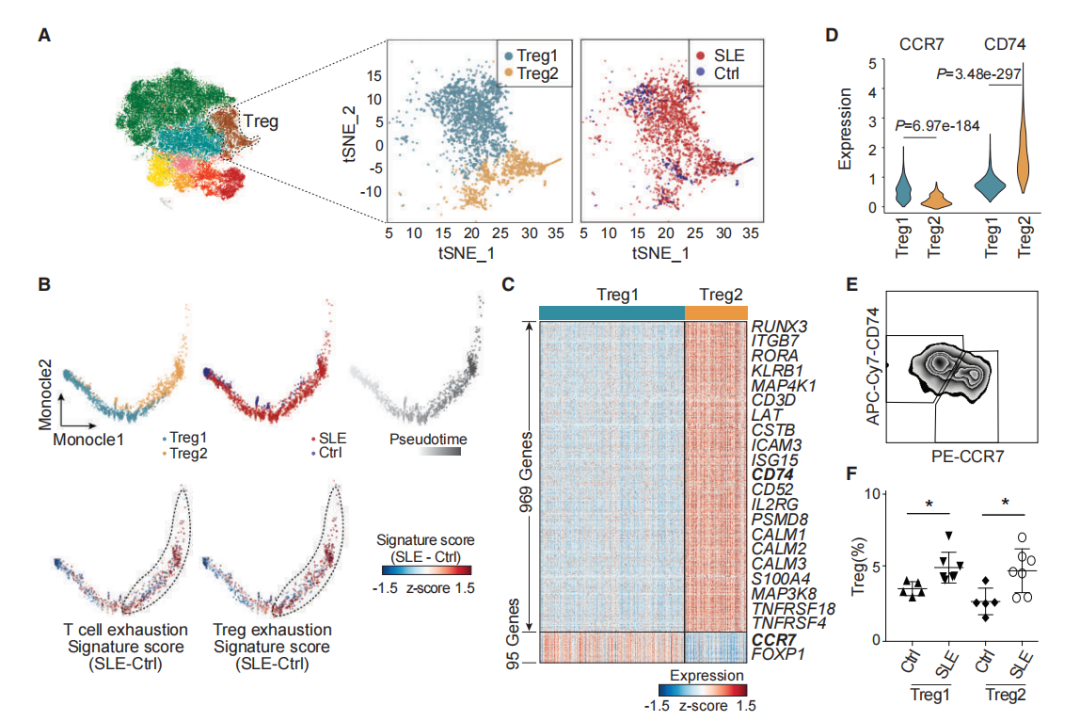 图5 SLE患者Treg细胞亚群及其功能分化
图5 SLE患者Treg细胞亚群及其功能分化

图6 CCR7low CD74hi Treg2细胞的衰竭样特性
6、过量的I型IFN促进SLE患者Treg细胞衰竭
之前的研究表明,持续性抗原或炎症信号的慢性刺激足以驱动T细胞的衰竭和功能缺陷。因此,研究者试图研究持续刺激炎症信号是否能诱导Treg细胞衰竭。将参与Treg细胞耗竭的基因的平均表达定义为Treg细胞耗竭特征评分(TES),然后对所有Treg细胞中表达与TES评分显著相关的基因进行排序和基因集富集分析(GSEA) (图7A)。在SLE患者中,Treg细胞耗竭相关基因和I型IFN信号通路相关基因的平均表达水平沿Treg细胞假时间轨迹高度相关(图7D-7F)。因此,假设持续刺激I型IFN信号可能会促进SLE患者原发性CD4+ T细胞中Treg细胞衰竭。
对从健康对照中纯化了原代Treg细胞,进行不同浓度的I型IFN刺激后进行转录组测序分析,与I型IFN信号通路的基因被成功诱导表达(图7G)。各样本中Treg耗竭相关基因的平均表达量也与I型IFN信号通路相关基因的平均表达量呈显著正相关(图7H ),表明I型IFN信号是导致SLE患者Treg衰竭的原因。此外,一项基于CFSE的T细胞抑制实验表明,IFNA处理的Treg细胞抑制Teff细胞增殖和激活的能力下降(图7I),进一步说明持续暴露于激活的IFN信号可以诱导Treg细胞衰竭。
综上所述,发现SLE患者的Treg细胞表现出与IFN信号相关的衰竭特征,并在体外验证了慢性IFN刺激可诱导Treg功能障碍。
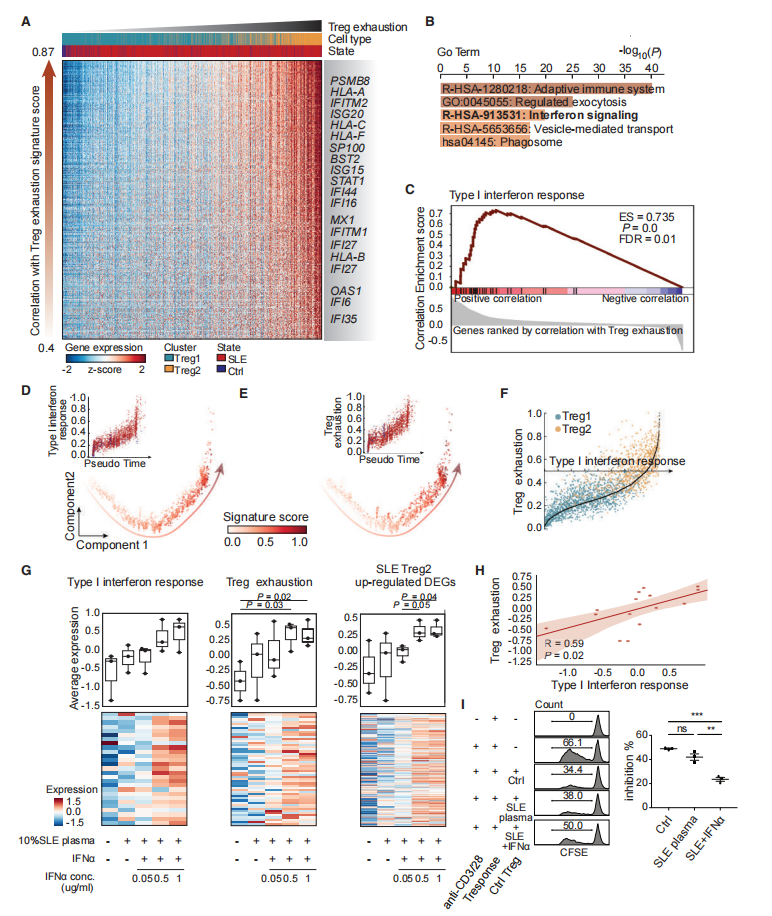
图7 慢性I型IFN刺激促进SLE患者Treg细胞衰竭
三、研究结论
在本研究中,利用ATAC-seq和scRNA-seq分析了SLE患者和健康对照的外周血CD4+ T细胞,CD4+ T细胞的染色质可及性与疾病严重程度相关。鉴定了两个Treg亚群,其中CCR7low CD74hi Treg2亚群是I型IFN诱导SLE患者Treg功能衰竭的特征亚群,慢性IFN刺激可诱导Treg功能障碍。本研究结果为SLE发病机制深入研究奠定了基础。
参考文献:
Single-cell transcriptome profiling and chromatin accessibility reveal an exhausted regulatory CD4+ T cell subset in systemic lupus erythematosus.[J]Cell Reports, 2022.
........................................................................................................................................................................................................











