2020年发表于《International Journal of Radiation Oncology Biology Physics》(IF = 7.4)
一、研究背景
肝癌(HCC)是中最常见的癌症,放射治疗虽然是肿瘤最重要的非手术治疗方法之一,但其临床疗效低、存在不良反应等问题仍有待解决。基因增敏治疗是基因治疗和放射治疗的结合,基因治疗肝癌可正向协同对肿瘤的治疗效果,并且可以减少放疗剂量,从而减少放疗带来的损害。
高通量基因组学技术已越来越多地用于目的基因的筛选和基因的功能研究。在这项研究中,我们分析了肝癌(HCC)组织、癌旁组织和HepG2细胞系在接受放射处理前后的基因组数据。经联合分析,所选靶基因CLTRN与肿瘤自身相关,放疗后CLTRN的表达显著增加,可能提示其为治疗靶点。如果CLTRN是肝癌放射治疗的一个基因靶点,增强该靶基因的表达是否能提高肝癌放射治疗的效果,是一个非常重要的研究方向。
本研究阐述了CLTRN敏化在肝癌(HCC)放射治疗中的应用,并研究了相关的上下游机制。
二、研究结果
1、CLTRN可能是肝癌(HCC)的肿瘤驱动基因之一和放疗的靶点
本研究分析了3对肝癌(HCC)细胞和癌旁组织的基因数据。通过分析HepG2细胞在x射线照射前后转录水平上蛋白编码基因的变化,筛选获得了13个感兴趣的靶基因(图1B)。然后通过荧光定量PCR分析了HepG2细胞中13个基因在x射线IR前后的转录水平变化,CLTRN变化最显著(图2A),最终选择CLTRN作为目的基因。在不同剂量的放射前后,CLTRN蛋白水平也发生了变化(图2B)。放疗后CLTRN的表达显著增加,且变化与放射剂量有关,这表明CLTRN可能是放射的靶基因。
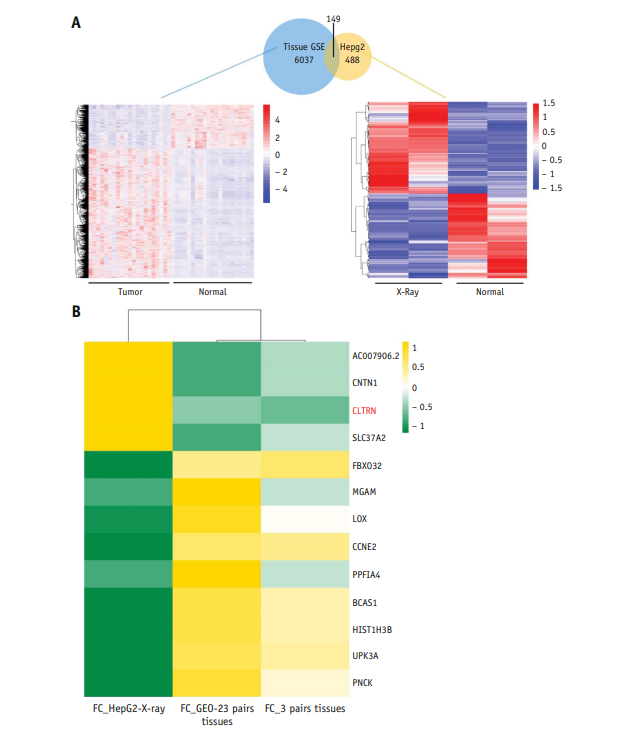
图1 肝癌(HCC)组织和放射处理肝癌细胞的RNA-seq
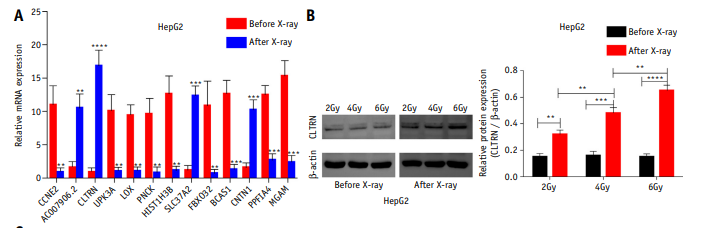
图2 CLTRN在肝癌(HCC)组织和细胞中弱表达,与肝癌(HCC)患者的预后相关
2、CLTRN在肝癌(HCC)细胞系和组织中低水平表达,并且与肝癌(HCC) 低生存率相关
CLTRN在肝癌(HCC)细胞中主要定位于膜,本研究在HepG2细胞中也证实了这一点(图2C)。为了进一步研究,选择30例成对的肝癌肿瘤和癌旁组织样本,采用实时定量PCR研究CLTRN在每个组织样本中的表达水平。结果表明,CLTRN在肿瘤组织中的表达水平显著低于正常组织(图2E)。另外,选取huh-7、mhcc-97h、smmc-7721、HepG2和正常干细胞LO2进行CLTRN表达水平分析。实验观察到CLTRN在肿瘤细胞中的表达水平低于正常细胞,尤其是HepG2细胞(图2D)。采用实时定量PCR,对所选生物库109个肿瘤组织中CLTRN的表达水平进行分析,并根据中位数将样本分为高表达组和低表达组。Kaplan-Meier分析显示,CLTRN表达水平较低时,肝癌患者的生存率较低,复发概率较高(图2F, 2G)。
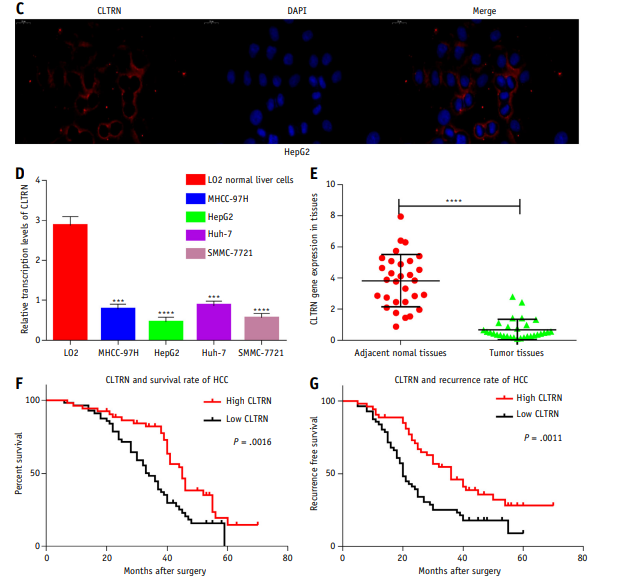
图2 CLTRN在肝癌(HCC)组织和细胞中弱表达,与肝癌(HCC)患者的预后相关
3、CLTRN过表达可增加体外肝癌(HCC)细胞的放射敏感性
为了研究CLTRN对肝癌(HCC)细胞放射敏感性的影响,HepG2和SMMC-7721细胞转染阴性对照(NC)或clone_CLTRN(图3A)结果表明高表达CLTRN与IR处理后的肝癌(HCC)细胞生存率降低有关(图3B)。迁徙和入侵实验显示,过表达CLTRN可降低IR处理后的肝癌(HCC)细胞的迁移和侵袭潜能(图3C, 3D)。但过表达CLTRN对IR处理后肝细胞凋亡及细胞周期无明显影响(图3E, 3F)。
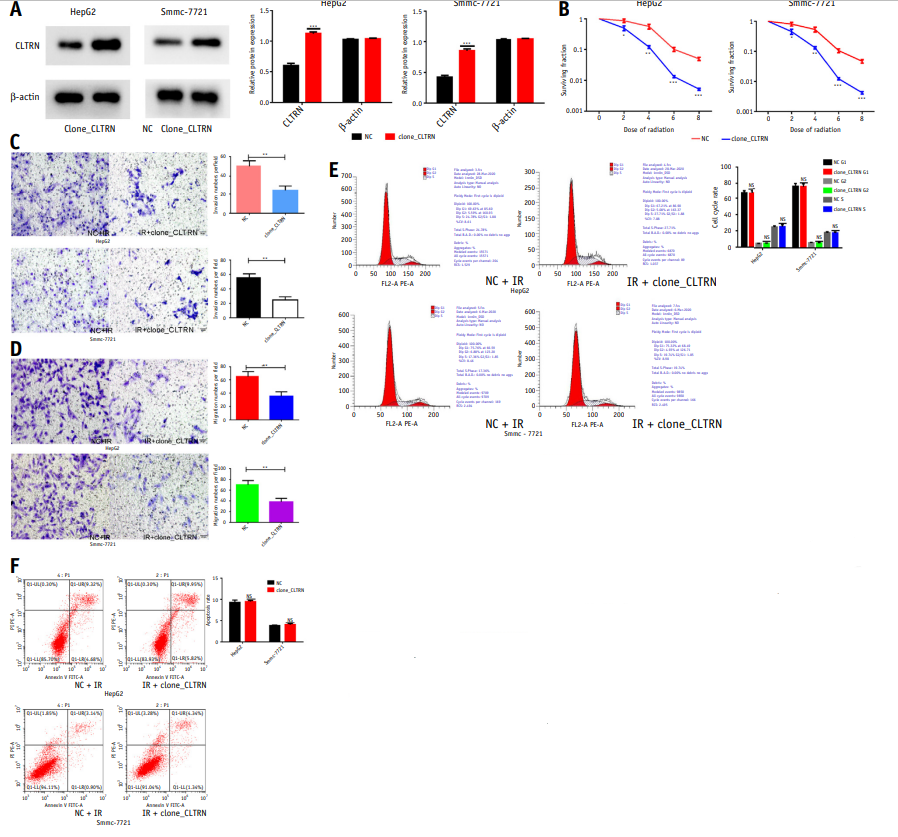
图3 CLTRN过表达可导致肝细胞癌(HCC)细胞体外和体内放射敏感性增加
4、CLTRN过表达可降低放射后裸鼠的致瘤性
为了研究裸鼠体内肿瘤的发生,建立了CLTRN稳定过表达的HepG2细胞。将24只裸鼠随机分为4组:NC, clone_CLTRN, NC+ IR和clone_CLTRN + IR。肿瘤生长过程中采用放射治疗,比较各组成瘤潜力。本研究观察到CLTRN过表达放射治疗后裸鼠的肿瘤体积最小,表明CLTRN过表达可增强肝癌细胞的放射敏感性。
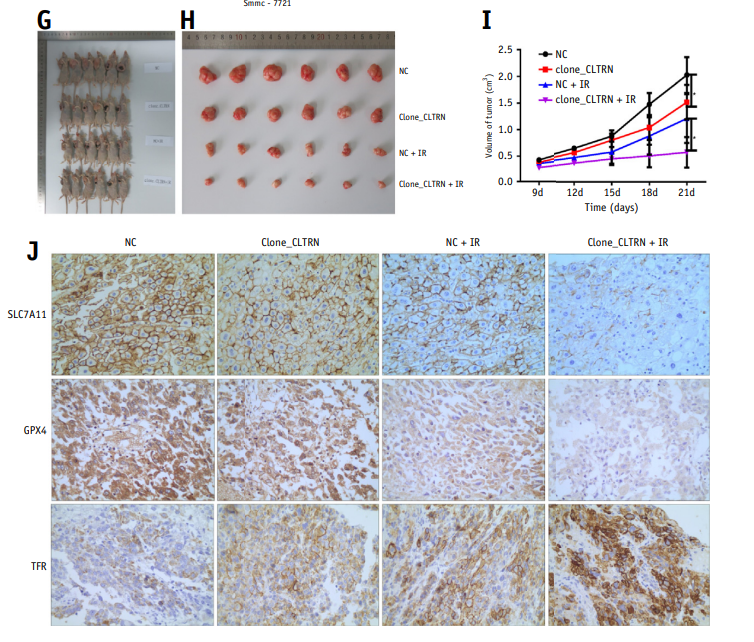
图3 CLTRN过表达可导致肝癌(HCC)细胞体外和体内放射敏感性增加
5、CLTRN主要与肝癌(HCC)细胞的谷胱甘肽代谢有关
本研究利用RNA-seq分析了HepG2细胞中CLTRN过表达后在转录水平上的变化(图4A, 4B)。通过KEGG富集分析,可知差异表达基因大多富集在谷胱甘肽代谢途径(图4C),因此假设CLTRN可能与谷胱甘肽代谢有关。
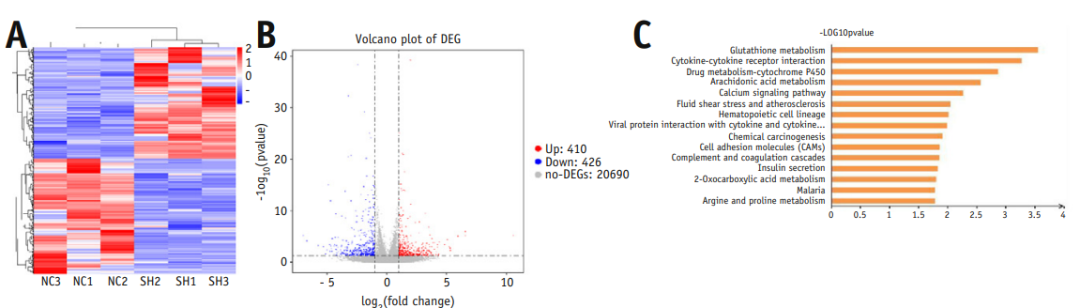
图4 CLTRN在肝癌细胞的谷胱甘肽代谢和铁死亡中起作用
6、CLTRN过表达可增加小鼠肝癌(HCC)细胞铁死亡,CLTRN可通过铁死亡途径增强肝癌细胞的放射敏感性
由于谷胱甘肽代谢是铁死亡的关键机制,所以假设CLTRN可能在铁死亡途径中发挥作用,并在HepG2和SMCC-7721细胞中进行了相关的验证实验。细胞被分为3组:NC、NC + IR和clone_CLTRN +IR,测定细胞裂解液中铁离子的浓度和脂质体中活性氧(ROS)的水平,并用透射电镜观察各组细胞器的变化。
研究结果表明放射可独立诱导细胞铁离子浓度的增加,并可增加细胞脂质体中的ROS水平(图4E, 4F),说明放疗可能引起肝癌(HCC)的铁死亡。透射电镜结果也显示NC + IR细胞内线粒体数量减少,膜密度增加,线粒体嵴数量减少。然而,与NC + IR组的细胞相比,CLTRN过表达后肿瘤细胞的放射敏感性显著增加。此外,在克隆CLTRN细胞中加入铁死亡抑制剂和诱导剂。放射治疗后,抑制剂组的ROS显著降低,而诱导剂组明显升高(图4H)。上述实验结果表明,CLTRN通过增加铁死亡来增强肿瘤细胞的放射敏感性。同时,过表达CLTRN的细胞中PTGS2、NOX1、ACSL4表达上调,GPX4、SLC7A11、FTH1表达下调,进一步证实CLTRN在铁死亡通路中的作用及其对肿瘤细胞增殖的影响(图4I)。
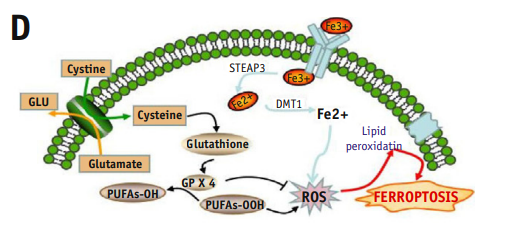
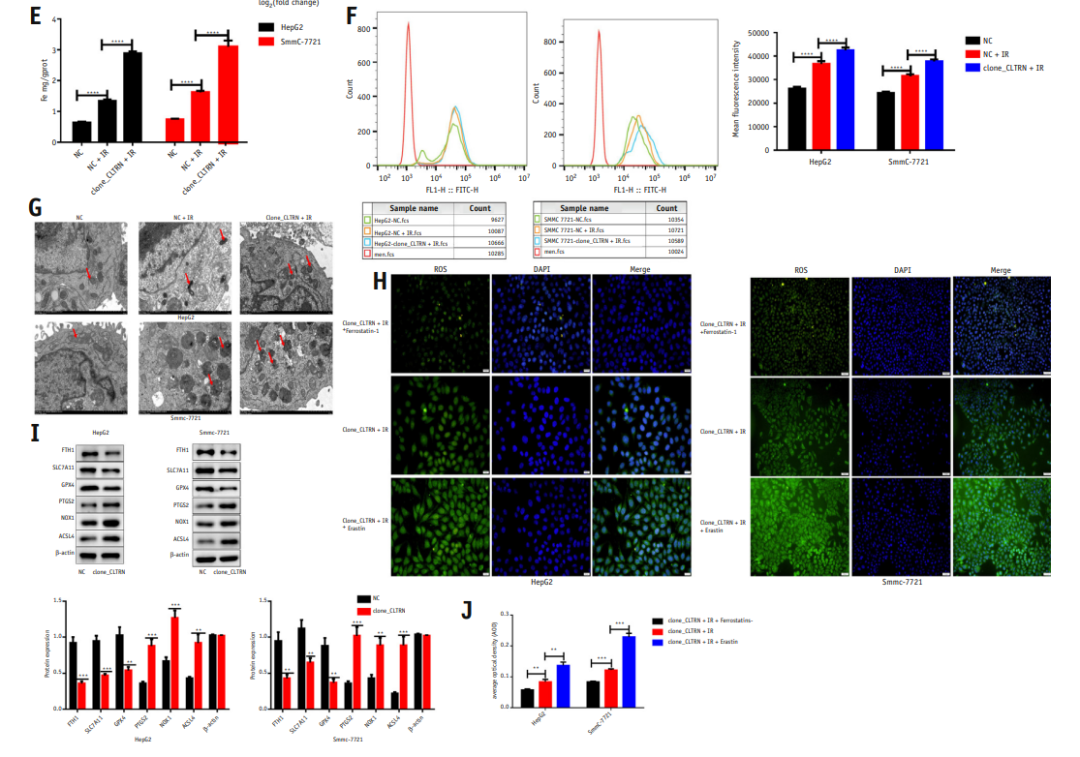
图4 CLTRN在肝癌细胞的谷胱甘肽代谢和铁死亡中起作用
7、NRF1是一种转录因子和CLTRN的上游调控因子
为了进一步研究了CLTRN的上游调控机制,选取了11个候选转录因子,并检测了这11个候选转录因子在肝癌(HCC)和癌旁标本中的RNA表达水平,发现YY1、HNF1A、PAX5、NRF1在肿瘤组织中下调,在癌旁组织中上调,这也与CLTRN的表达模式一致(图5B)。随后,对这4个基因设计了干扰序列,并在HepG2细胞中成功实现了干扰。
为了进一步研究了CLTRN的上游调控机制,选取了11个候选转录因子,并检测了这11个候选转录因子在肝癌(HCC)和癌旁标本中的RNA表达水平,发现YY1、HNF1A、PAX5、NRF1在肿瘤组织中下调,在癌旁组织中上调,这也与CLTRN的表达模式一致(图5B)。随后,对这4个基因设计了干扰序列,并在HepG2细胞中成功实现了干扰。
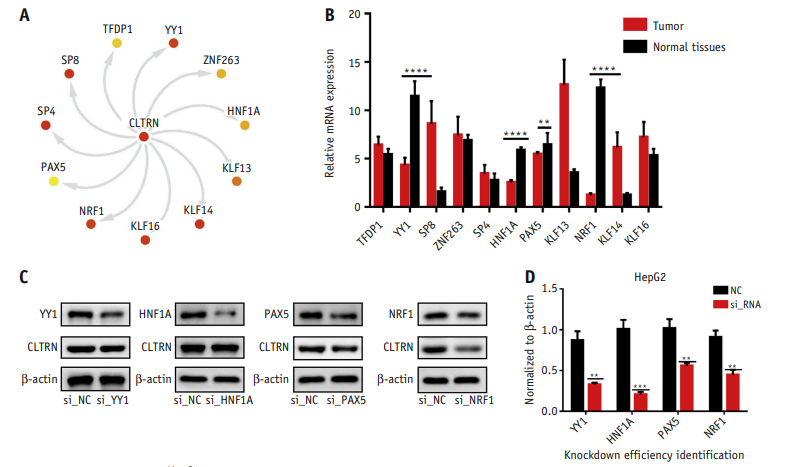
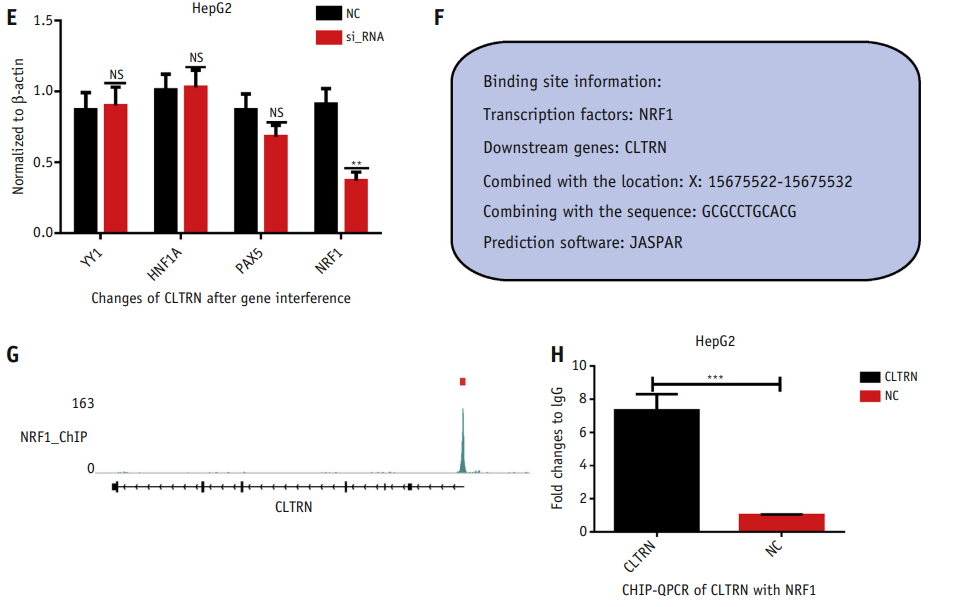
图5 NRF1是肝癌(HCC)细胞中CLTRN的上游转录因子
8、RAS癌基因家族成员和二氢脂酰胺脱氢酶是肝癌(HCC)细胞中NRF1的相互作用蛋白
为研究肝癌(HCC)中NRF1的相互作用蛋白,以HepG2细胞为研究对象,使用NRF1抗体进行免疫沉淀。考马斯蓝染色后,对样品进行电泳,从凝胶中切割出相应片段,进行质谱分析(图6A, B)。对于质谱分析得到的前100个蛋白,在GEPIA数据库中进行相关筛选,筛选出R值>0.3的蛋白;并通过UniProt数据库确定RAS癌基因家族(RAN)和二氢脂酰胺脱氢酶(DLD)为靶蛋白(图6C, 6D)。免疫荧光实验显示RAN和DLD确实位于HepG2细胞的细胞核中(图6E)。最后,在共免疫沉淀实验中,我们证实RAN和DLD是NRF1的相互作用蛋白(图6F)。
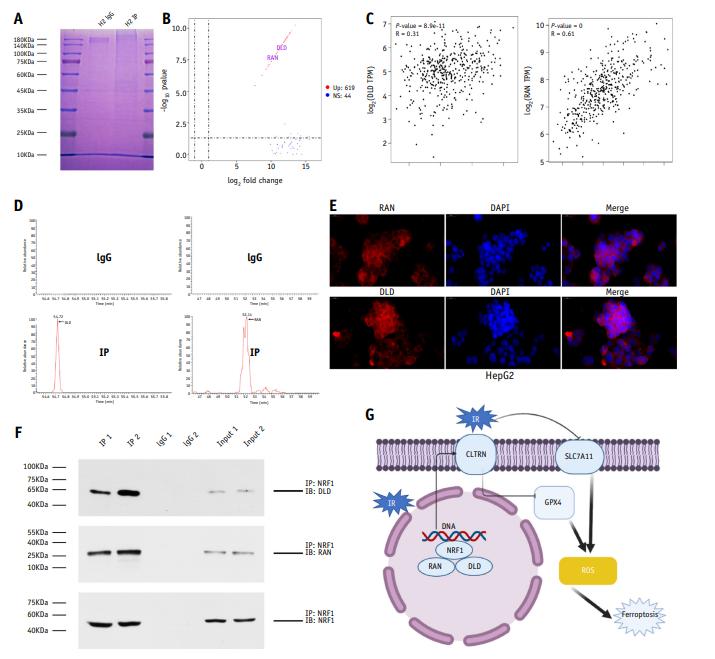
图6 RAN和DLD是肝癌(HCC)细胞中的NRF1相互作用蛋白
三、研究结论
本研究发现了一个新的肝癌(HCC)放射敏感性基因CLTRN,并研究了其上下游调控机制。CLTRN作为放射靶点,受NRF1/RAN/DLD蛋白复合物调控,通过铁死亡增强肝癌(HCC)细胞的放射敏感性,可作为肝癌(HCC)治疗的一种新的治疗靶点或预后标志物。
参考文献:
CLTRN, Regulated by NRF1/RAN/DLD Protein Complex, Enhances Radiation Sensitivity of Hepatocellular Carcinoma Cells Through Ferroptosis Pathway.[J]International Journal of Radiation Oncology Biology Physics, 2020.










